
【题目】在容积一定的密闭容器中,进行可逆反应A(g)+2B(g) ![]() C(g) +D(g),有图Ⅰ、Ⅱ所示的反应曲线,下列说法中不正确的是( )
C(g) +D(g),有图Ⅰ、Ⅱ所示的反应曲线,下列说法中不正确的是( )
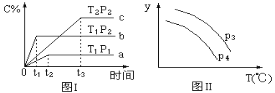
A. 正反应是放热反应
B. P1 <P2
C. 若P3<P4,y轴表示A的转化率
D. 若P3>P4,y轴表示C的体积分数
【答案】C
【解析】
由图(Ⅰ)中a、b的相对位置知,温度相同时,p2先达到化学平衡,反应速率较快,则p2>p1;由b、c的相对位置知,压强相同时,T1先达到化学平衡,反应速率较快,则T1>T2,升高温度,C%降低说明正反应为放热反应。
A项、由b、c的相对位置知,压强相同时,T1先达到化学平衡,反应速率较快,则T1>T2,升高温度,C%降低说明正反应为放热反应,故A正确;
B项、由a、b的相对位置知,温度相同时,p2先达到化学平衡,反应速率较快,则p2>p1,故B正确;
C项、增大压强,平衡正向移动,A的转化率增大,则有P4<P3,故C错误;
D项、增大压强,平衡正向移动,C的体积分数,则有P4<P3,故D正确。
故选C。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】(1) KClO3+ 6HCl (浓)=3Cl2 ↑+KCl +3H2O其中氧化剂为______;还原产物为_______;氧化产物与还原产物的质量比为_________; 浓盐酸在反应中表现出来的性质是 ________ (填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)用双线桥法标出以上反应的电子转移的方向和数目___________
(3)Fe(OH)3胶体的制备:取一小烧杯,加入25 mL蒸馏水,加热至沸腾,然后向沸水中逐滴加入5 ~ 6滴___________,继续煮沸至体系呈______________,停止加热,即制得Fe(OH)3胶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)醇的官能团的名称是_____。
(2)某气态有机物相对于氢气的密度为14,则其结构简式为_____。
(3)某有机物的结构简式如图所示,则其一氯代物共有_____种。

(4)新戊烷用系统命名法命名应为_____。
(5)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是_____(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_____(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.单位时间内生成nmolA2同时生成nmolAB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2nmolAB同时生成nmolB2
D.单位时间内生成nmolA2同时生成nmolB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即用表面皿盖好。(已知2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O)
2KCl+2MnCl2+5Cl2↑+8H2O)
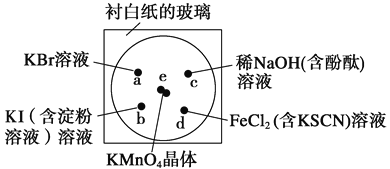
(1)e处反应的离子方程式为_________________________________________。该反应中氧化剂和还原剂的物质的量之比为_______________________。
(2) d处的实验现象:__________________________________________。
(3)c处反应的化学方程式为_________________________________。标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为__________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?__________(填“能”或“不能” ),若能,其氧化性由强到弱的顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关分子结构如图所示,下列叙述中,正确的是 ( )
![]()
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 所有的原子都在同一平面上
C. 12个碳原子不可能都在同一平面上
D. 12个碳原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:现有以下几种物质①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸钠、⑥亚硫酸氢钠、⑦氨水。请回答下列问题:
(1)以上物质属于弱电解质的是______________(填序号);
(2)常温下④的溶液pH_____7(填“>”“<”或“=”),原因__________(用离子方程式表示);
(3)⑥的水溶液中呈酸性,原因是__________________________;
(4)常温下,将aL pH=11的NaOH溶液与bL pH=1的HNO3溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________。
(5)已知:a.常温下,醋酸和NH3H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈______性。
(6)对于醋酸溶液和醋酸钠溶液的下列说法正确的是____________;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解。
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.常温下,醋酸和醋酸钠等体积等浓度混合,溶液呈碱性。
II:25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。
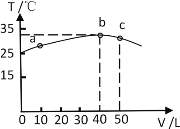
(7)由图可以推出HA溶液的物质的量浓度为_______________,25℃时,pH=3的HA溶液的电离度为______________。
(8)b点溶液中离子浓度由大到小的顺序为_______________________。
(9)加入NaOH溶液至溶液呈中性时出现在图中的位置_________(填“b点前” “b点”或“b点后”),溶液呈中性时,存在:c(A-)______c(Na+)(填“>”“<”或“=”)。
III:(10)已知:Ksp[Al(OH)3]=1×10-33, pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Al3+(使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:

(1)A元素气态氢化物的电子式___,A、B、C、D四种元素按原子半径由大到小的顺序排列为___。(填元素符号)
(2)A的最高价氧化物与氢氧化钠反应的离子方程式为___。
(3)A,C,D的最高价氧化物对应水化物的酸性强弱_______,C的氢化物比D的氢化物沸点___(填“高”或“低”),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.室温下,将0.1mol·Lˉ1的HCl溶液加水稀释10倍,所得溶液的pH=2
B.室温下,pH=3的HCl溶液和pH=11的NaOH溶液中,c(Cl)=c(Na+)
C.0.1mol·Lˉ1的NaOH溶液与等体积CH3COOH溶液混合,若所得溶液呈中性,则c(CH3COOH)>0.1mol·Lˉ1
D.加热蒸馏水时,水的离子积常数Kw增大,c(H+)逐渐增大,c(OH)逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com