
【题目】室温时纯水中存在电离平衡:H2OH++ OH-。下列叙述正确的是
A.升高温度,水的电离程度增大,c(H+)增大,pH<7,溶液显酸性
B.向水中加入少量氨水,平衡逆向移动,抑制水的电离,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,由水电离出的 c(H+)>1×10-7 mol/L
D.向水中加入少量 NH4Cl 固体,![]() 结合水电离出的 OH-,由水电离出的c(H+)>1×10-7 mol/L
结合水电离出的 OH-,由水电离出的c(H+)>1×10-7 mol/L
【答案】D
【解析】
A. 升高温度,水的电离程度增大,c(H+)增大,pH<7,但溶液中c(H+)仍然等于c(OH-),溶液显中性,故A错误;
B. 向水中加入少量氨水,由于c(OH-)增大导致平衡逆向移动,抑制水的电离,移动的结果只能减弱这种变化,故c(OH-)增大,故B错误;
C. 向水中加入少量硫酸,c(H+)增大导致平衡逆向移动,抑制水的电离,故由水电离出的 c(H+)<1×10-7 mol/L,故C错误;
D. 向水中加入少量 NH4Cl 固体,![]() 结合水电离出的OH-,导致平衡正向移动,促进水的电离,故由水电离出的c(H+)>1×10-7 mol/L,故D正确;
结合水电离出的OH-,导致平衡正向移动,促进水的电离,故由水电离出的c(H+)>1×10-7 mol/L,故D正确;
故答案为:D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系:
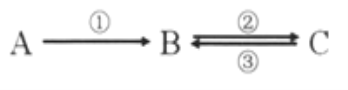
其中①②③均为有单质参与的反应。
(1)若A是常见的金属,①③中均有同一种黄绿色气体参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_________________________。
(2)如何检验上述C溶液中的阳离子?______________________。
(3)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是____________,属于置换反应____________,(填序号)写出反应①的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,在浓度为
时,在浓度为![]() 的
的![]() 、
、![]() 、
、![]() 的溶液中,已知醋酸的电离常数约等于一水合氨的电离常数,下列判断正确的是
的溶液中,已知醋酸的电离常数约等于一水合氨的电离常数,下列判断正确的是![]()
A.由水电离出的![]() 最大的是
最大的是![]()
B.三种溶液的pH值最小的![]()
C.三种溶液中![]() 最大的是
最大的是![]()
D.三种溶液中只有![]() 显碱性
显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(﹣lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(﹣lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是

A. 该反应的△H>0
B. A点对应状态的平衡常数K(A)=10﹣2.294
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30℃时,B点对应状态的υ(正)< υ(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
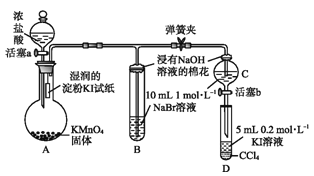
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ………
(1)A中产生黄绿色气体,其电子式是________。
(2)验证氯气的氧化性强于碘的实验现象是_______。
(3)B中溶液发生反应的离子方程式是_______。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是___________。
(5)过程Ⅲ实验的目的是__________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能离逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
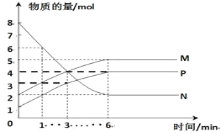
(1)反应化学方程式中各物质的系数比为a:b:c=______。
(2)1min到3min这段时刻,以M的浓度变化表示的平均反应速率为:_____。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗amolN,同时消耗bmolM
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向
时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 乙苯,发生反应:
乙苯,发生反应:
![]()
![]() 。
。
经一段时间后达到平衡,反应过程中测定的部分数据见下表:
时间 | 0 | 10 | 20 | 30 | 40 |
|
|
|
|
|
|
|
|
|
|
|
|
下列说法正确的是![]()
![]()
A.前![]() ,
,![]()
B.若保持其他条件不变,升高温度,平衡时![]() 乙苯
乙苯![]() ,则
,则![]()
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为![]()
D.相同温度下,起始时向容器中充入![]() 乙苯、
乙苯、![]() 苯乙烯和
苯乙烯和![]() ,达到平衡前
,达到平衡前![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温密闭容器中发生反应:CaCO3(s)![]() CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是
CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是

A. υ逆(逆反应速率) B. ρ(容器内气体密度)
C. m(容器内CaO质量) D. Qc(浓度商)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下合成甲醇的反应为;CO(g)+2H2(g)![]() CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是

A. 该反应的△H1>0,且K1>K2
B. 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压
C. 300℃时,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移动
D. 500℃时,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2浓度和百分含量均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com