
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,下列说法错误的是( )
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | a |
乙 | c1 | 0.2 | 7 |
丙 | 0.2 | 0.1 | 7 |
丁 | 0.1 | 0.1 | 9 |
A. 若a=7,HA为强酸;若a>7,HA为弱酸
B. 单从乙组情况分析,c1不一定等于0.2molL-1,混合溶液中离子浓度c(A-)=c(Na+)
C. 从丙组实验结果分析,HA是弱酸,混合溶液中离子浓度c(Na+)=c(A-)>c(OH-)=c(H+)
D. 丁组实验所得混合溶液中由水电离出的c(OH-)=1×10-5 molL-1,c(OH-)-c(HA)= 1×10-10molL-1
【答案】D
【解析】A、甲组实验中等浓度、等体积的HA和NaOH混合,二者恰好反应生成NaA和水。如果混合溶液pH=7,则NaA是强酸强碱盐,HA是强酸;如果溶液pH>7,则NaA是强碱弱碱盐,HA是弱酸,故A正确;B、乙组实验中溶液混合pH=7, 如果NaA是强酸强碱盐,其水溶液呈中性,则HA与NaOH为等体积等浓度混合,此时c1等于0.2molL-1;如果NaA是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性,则HA应该稍微过量,此时c1>0.2molL-1,故B正确;C、丙组实验,HA的浓度是NaOH的两倍,等体积混合后所得溶液溶质为NaA和HA,物质的量之比为1∶1,此时溶液呈中性,说明A-的水解程度等于HA的电离程度,故HA是弱酸,溶液中离子浓度大小为c(Na+)=c(A-)>c(OH-)=c(H+),故C正确;D、丁组实验HA与NaOH等浓度等体积混合,反应后溶质为NaA,溶液pH=9,则NaA为强碱弱酸盐;c(H+)=10-9mol/L,c(OH)=  。根据质子守恒:c(H+)+ c(HA)= c(OH),所以c(OH-)-c(HA)= c(H+)=10-9mol/L,故D错误。故选D。
。根据质子守恒:c(H+)+ c(HA)= c(OH),所以c(OH-)-c(HA)= c(H+)=10-9mol/L,故D错误。故选D。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存的是
A. Na+、Mg2+、Cl-、OH- B. H+、Ca2+、CO32-、NO3-
C. Cu2+、K+、SO42-、NO3- D. Na+、H+、OH-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
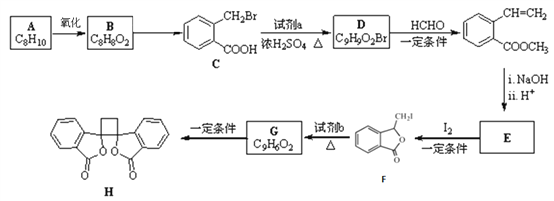
已知:
ⅰ. ![]()
ⅱ. ![]()
ⅲ. 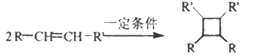
(以上R、R’、R”代表氢、或烃基等)
(1)A属于芳香烃,名称是______________,由B生成C的反应类型是________________。
(2)试剂a是_________________,HCHO的电子式是________________。
(3)E的结构简式是_________________。
(4)由F生成G的化学方程式是____________________。
(5)二取代芳香化合物W是 同分异构体,能使溴的四氯化碳溶液反应,能发生银镜反应,W共有____种(不含立体结构)。其中核磁共振氢谱为五组峰的结构简式为________。
同分异构体,能使溴的四氯化碳溶液反应,能发生银镜反应,W共有____种(不含立体结构)。其中核磁共振氢谱为五组峰的结构简式为________。
(6)以乙醇为起始原料,结合已知信息选用必要的无机试剂合成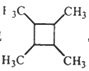 ,写出合成路线(用简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)__________________。
,写出合成路线(用简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应: 3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L-1。下列判断正确的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L-1。下列判断正确的是( )
A. x=2 B. A的平均反应速率为0.6 mol·L-1·min-1
C. 平衡常数约为0.15 D. 若混合气体的密度不变则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.KCl=K++Cl-B.MgCl2=Mg2++Cl2-
C.KOH=K++O2-+H+D.H2SO4=H2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为 .
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是(用元素符号表示)
(3)As4O6的分子结构如图1所示,其中As原子的杂化方式为 , 1mol As406含有σ键的物质的量为 . 
(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图2所示.则Y轴可表示的氢化物(RH3)性质可能是 . 
A.稳定性
B.沸点
C.R﹣H键能
D.分子间作用力
(5)AsH3的沸点(﹣62.5℃)比NH3的沸点(﹣33.5℃)低,原因是
(6)NH4+中的H﹣N﹣H的键角比 NH3中的H﹣N﹣H的键角(填”大”或”小”),原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.已知CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如表:下列叙述正确的是( )
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A.该反应的正反应是吸热反应
B.该反应达到平衡后,保持容器体积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C.830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻υ正<υ逆
D.830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性. 物质 ![]() 有光学活性,发生下列反应:
有光学活性,发生下列反应:
①与乙酸发生酯化反应 ②与NaOH水溶液反应 ③在Cu作催化剂时与O2反应 ④与银氨溶液反应.发生哪些反应后生成的有机物无光学活性(填写符合题意的字母编号)
A.只有①②
B.只有②③
C.①②③
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A. ①③ B. ②④⑤
C. ①④⑤ D. ①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com