
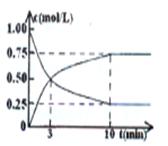
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在1 L固定体积的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,CO2的平均反应速率
v(CO2)= ;
(2)该反应的平衡常数表达式K= ;
(3)能判断该反应是否达到化学平衡状态的依据是
(多选扣分);
a.容器中压强不变 b.v正(H2)=v逆(H2O)
c.混合气体中c(H2O)不变 d.c(CO2)=c(CH3OH)
(4)下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
a.升高温度 b.将CH3OH(g)及时液化抽出
c.选择高效催化剂 d.再充入H2O(g)
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:阅读理解
过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
(1)写出吸收池中主要反应的离子方程式 ;
在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括 。
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。当电子转移的物质的量为 时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。
某密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
①若A、B两点表示在某时刻达到的平 衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K= ;此时在B点时容器的体积VB 10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高 CO转化率可采取的措施是 (答出两点即可)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省“五市十校”高三12月联合检测化学试卷(解析版) 题型:填空题
过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径。煤综合利用的一种途径如图所示。

(1)已知①C(s) + H2O(g) = CO(g)+H2(g) ΔH1=+131.3 kJ·mol-1
②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ΔH2=+90 kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 ________________________,
(2)用下图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是_______________________。

(3)在压强为0.1 MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:

①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100 ℃时,CO(g)+2H2(g)
 CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
(4)如图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ·mol-1)的变化:

关于该反应的下列说法中,正确的是________(填编号)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
(5)为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol
CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:

①从反应开始到平衡,CO2的平均反应速率v(CO2)=________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省“五市十校”高三12月联合检测化学试卷(解析版) 题型:填空题
过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径。煤综合利用的一种途径如图所示。

(1)已知①C(s) + H2O(g) = CO(g)+H2(g) ΔH1=+131.3 kJ·mol-1
②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ΔH2=+90 kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 ________________________,
(2)用下图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是_______________________。

(3)在压强为0.1 MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
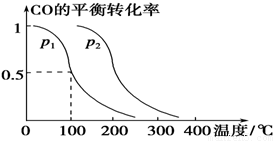
①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100 ℃时,CO(g)+2H2(g)
 CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
(4)如图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ·mol-1)的变化:

关于该反应的下列说法中,正确的是________(填编号)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
(5)为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol
CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:

①从反应开始到平衡,CO2的平均反应速率v(CO2)=________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源:2014届江苏南京学大教育专修学校高二3月月考化学试卷(解析版) 题型:填空题
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的
资源。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,
在1 L固定体积的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)
ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从反应开始到平衡,CO2的平均反应速率v(CO2)= ;
(2)该反应的平衡常数表达式K= ;
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分);
a.容器中压强不变 b.v正(H2)=v逆(H2O)
c.混合气体中c(H2O)不变 d.c(CO2)=c(CH3OH)
(4)下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
a.升高温度 b.将CH3OH(g)及时液化抽出
c.选择高效催化剂 d.再充入H2O(g)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省高三第三次模拟考试(理综)化学部分 题型:填空题
过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下:

(1)写出吸收池中主要反应的离子方程式 ;
在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括 。
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。当电子转移的物质的量为 时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。
某密闭容器中充有10
mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。

①若A、B两点表示在某时刻达到的平 衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K= ;此时在B点时容器的体积VB 10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高 CO转化率可采取的措施是 (答出两点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com