
| A. | 从1L1mol/L的NaCl溶液中取出500 ml,其浓度是0.5mol/L | |
| B. | 制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) | |
| C. | 0.5L 2mol/LBaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 | |
| D. | 10g 98%硫酸(密度为1.84g/cm3)与1OmL 18.4mol/L硫酸的浓度是相同的 |
分析 A.依据溶液具有均一性解答;
B.依据n=CV=$\frac{V}{Vm}$计算解答;
C.依据n=CV计算氯化钡的物质的量,结合1mol氯化钡含有1mol钡离子和2mol氯离子解答;
D.依据c=$\frac{1000ρω}{M}$计算10g 98%硫酸物质的量浓度结合溶液浓度与所取质量、体积无关解答;
解答 解:A.溶液具有均一性,浓度与所取体积无关,故A错误;
B.制成0.5L10mol/L的盐酸,需要标况下氯化氢气体为:0.5L×10mol/L×22.4L/mol=112L,故B正确;
C.0.5L 2mol/LBaCl2溶液中,含有氯化钡的量为:0.5L×2mol/L=1mol,共含有3mol离子,所以Ba2+和Cl-总数为3×6.02×1023,故C正确;
D.98%硫酸(密度为1.84g/cm3)物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,溶液浓度所取质量、体积无关,故D正确;
故选:A.
点评 本题考查了有关物质的量浓度计算,熟悉物质的量浓度与质量百分数浓度之间换算公式,明确溶液均一性是解题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 分子是为C5H12O且可与金属钠反应放出氢气的有机物有 (不考虑立体异构) 8种 | |
| D. | 某单炔烃,氢化后的产物结构简式为: ,则该烃可能有的结构有4种 ,则该烃可能有的结构有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
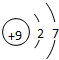 ;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)
;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)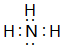 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 香精里面含有酯类物质,工业上以A为主要原料来合成酯C4H8O2,其合成路线如图所示.其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.又知2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.
香精里面含有酯类物质,工业上以A为主要原料来合成酯C4H8O2,其合成路线如图所示.其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.又知2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.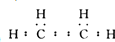
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
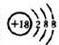 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应中反应物的总焓大于生成物的总焓 | |
| B. | 原子组成分子一定放出热量 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 化石燃料在地球上的蕴藏量是有限的,而且又都是经过亿万年才能形成的非再生资源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com