
 淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用.
淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
| n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
分析 I.(1)化学平衡常数为平衡时,生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
(2)温度不变,利用浓度商与化学平衡常数的大小,判断平衡移动方向,得到答案;
Ⅱ.(3)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(4)正反应为放热反应,升高温度,平衡逆向移动;
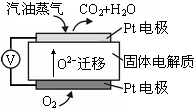
Ⅲ.(5)电解质能在高温下能传导O2-,负极发生氧化反应,即C6H14失去电子生成CO2,根据质量守恒和电荷守恒写出电极反应式;
(6)一个电子的电量是1.602×10-19C,当电路中通过1.929×105 C的电量时,电子的个数=$\frac{1.929×1{0}^{5}C}{1.602×1{0}^{-19}C}$=1.204×1024,电子的物质的量=$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=
2mol,根据转移电子和氢气的关系式计算.
解答 解:(1)从反应开始到2min时,H2O的物质的量变化量为0.3mol,则生成0.3mol氢气,用H2表示的反应速率为v(H2)=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol••L-1•min-1;
反应物和生成物浓度不变时,达到平衡状态,3min后达到平衡状态,容器体积为2L,则c(H2O)=0.350mol/L,c(CO)=0.150mol/L,c(H2)=c(CO2)=
0.600mol/L-0.350mol/L=0.250mol/L,化学平衡常数表达式为:K=$\frac{[C{O}_{2}]•[{H}_{2}]}{[CO]•[{H}_{2}O]}$═$\frac{0.250×0.250}{0.350×0.150}$=1.2,
故答案为:0.075mol••L-1•min-1;1.2;
(2)向2L恒容密闭容器中充入1mol CO、1mol H2O(g)、2mol CO2、2mol H2,各物质浓度分别为:0.5mol/L、0.5mol/L、1mol/L、1mol/L,浓度商=$\frac{1×1}{0.5×0.5}$=4>1.2,平衡向逆反应方向移动,所以υ(正)<υ(逆),
故答案为:<;
Ⅱ.(3)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-$\frac{2}{3}×$②得反应CO(g)+2H2(g)=CH3OH(l),该反应的反应热△H═-283.0kJ•mol-1+(-286kJ•mol-1)-$\frac{2}{3}×$(-726.5kJ•mol-1)=-129kJ•mol-1,CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1;
(4)正反应为放热反应,升高温度,平衡逆向移动,则升高温度使反应速率加快,平衡左移,CH3OH产率减小,
故答案为:升高温度使反应速率加快,平衡左移,CH3OH产率减小;
(5)电解质能在高温下能传导O2-,负极发生氧化反应,即1molC6H14失去电子生成CO2,共失去38mole-,电极反应为:C6H14-38e-+19O2-=6CO2+7H2O,
故答案为:C6H14-38e-+19O2-=6CO2+7H2O;
(6)一个电子的电量是1.602×10-19C,当电路中通过1.929×105 C的电量时,电子的个数=$\frac{1.929×1{0}^{5}C}{1.602×1{0}^{-19}C}$=1.204×1024,电子的物质的量=$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=2mol,根据转移电子和氢气的关系式得氢气的物质的量为1mol,则体积为22.4L,
故答案为:22.4.
点评 本题考查较为综合,涉及影响化学平衡的计算、热化学方程式以及电解等知识,难度较大,构建平衡建立的途径进行比较是关键;探讨了能源的循环利用和温室效应的解决,着重考查了物质催化反应的过程,结合考查了化学反应速率和对图表的理解解析能力,综合能力要求较高.


科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Na+、Ca2+、SO42-、CO32- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | 氯水溶液:H+、Fe2+、SO42-、Cl- | |
| D. | 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
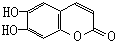 )具有抗癌作用.下列关于七叶树内酯的叙述中不正确的是( )
)具有抗癌作用.下列关于七叶树内酯的叙述中不正确的是( )| A. | 能被KMnO4酸性溶液氧化 | |
| B. | 既可以看成酚类化合物又可看成酯类化合物 | |
| C. | 能与银氨溶液发生银镜反应 | |
| D. | 1 mol该物质最多与3 mol Br2 发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3CH2)2CHCH3的正确命名是2-乙基丁烷 | |
| B. | 有机物大多是分子晶体,则乙醇的沸点和它相对分子质量相近的烷烃相差不多 | |
| C. | 鉴别淀粉、蛋白质、葡萄糖水溶液,依次可分别使用的试剂且对应的现象,碘水、变蓝色;硫酸铜溶液,白色沉淀;新制Cu(OH)2,加热后有砖红色沉淀 | |
| D. | 验证某有机物属于烃,应完成的实验内容是测定该试样的质量及试样完全燃烧后生成CO2和H2O的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.1molC8H18所含有的共价键数目为2.5NA | |
| B. | 1L 1 mol•L-1 FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA | |
| C. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA | |
| D. | 28.6gNa2CO3•10H2O溶于水配成1L溶液,该溶液中阴离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往紫色石蕊试液中加入盐酸,溶液变红 | |
| B. | 饱和FeCl3溶液在沸水中变成红褐色胶体 | |
| C. | 向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 | |
| D. | SO2使滴有酚酞的NaOH溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电化学应用 | 相关解释或说法 | |
| A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B | 电解CuCl2溶液 | 电子经过负极→阴极$\stackrel{通过电解液}{→}$阳极→正极 |
| C | 弱酸性环境下钢铁腐蚀 | 负极产生H2,正极处吸收O2 |
| D | 将铜闸门与外加电源负极相连 | 牺牲阳极的阴极保护法,可防止钢闸门腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
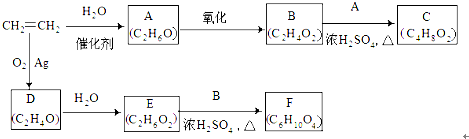
 E
E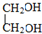 F
F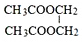 写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH
写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH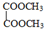 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com