
����Ŀ����ҵ����ȡ�������(K2FeO4)��������ȡ�������ƣ�Ȼ���ڵ����£�������������Һ�м���KOH�����;Ϳ�������������ء�ʪ���Ʊ�Na2FeO4����Ҫ��ӦΪ��2Fe(OH)3+3ClO��+4OH����2FeO42��+3Cl��+5H2O���ɷ���Na2FeO4����Ҫ��ӦΪ��2FeSO4+6Na2O2��2Na2FeO4+2Na2SO4+O2���������й�˵������ȷ����(����)
A.ʪ���ɷ��Ʊ��У�����1molNa2FeO4ת�Ƶ�����Ŀ��ͬ
B.��������ڵ����µ��ܽ�ȱȸ������Ƶ��ܽ��С
C.�ɷ��Ʊ�����Ҫ��Ӧ��Na2O2��������
D.K2FeO4����ˮʱ������ɱ�����������ɵ�Fe(OH)3���廹������ˮ�е���������
���𰸡�AC
��������
����������ԭ����ԭ���������ϵ�������ӵ�ת�ơ�����������ԭ����������ֱ������![]() �������������ʡ�
�������������ʡ�
A��ʪ����ÿ����1molNa2FeO4����1molFe(OH)3�μӷ�Ӧ�����ϼ���+3�����ߵ�+6�ۣ�ת�Ƶ���3mol���ɷ���ÿ����1molNa2FeO4����1molFeSO4�μӷ�Ӧ�����ϼ���+2�����ߵ�+6�ۣ�ת�Ƶ���4mol��ͬʱ����0.5mol�������ɣ���ת��1mol���ӣ���������1molNa2FeO4ת�Ƶ�����Ŀ����ͬ����A����
B���ڵ����£�����������ױ�ɹ������������Ը�������ڵ����µ��ܽ�ȱȸ������Ƶ��ܽ��С����B��ȷ��
C����Ӧ��Na2O2��OԪ�صĻ��ϼۼ������ֽ��ͣ���ɷ��Ʊ�����Ҫ��Ӧ��Na2O2�������������ǻ�ԭ������C����
D��K2FeO4����ǿ�����ԣ�������ǿ��������ɱ�����������ɵ�Fe(OH)3������������ԣ��������������D��ȷ��
��ѡAC��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⡢̼���ȵĵ��ʼ����������������������й㷺��;��
��1��H2(g)+Cl2 (g) =2HCl(g) ��H��Ӧ�������仯ʾ��ͼ��ͼ1��ʾ������436kJ/mol��ʾ�ĺ�����_____����ͼ������H=____kJ/mol��
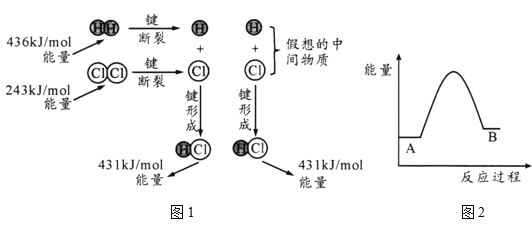
��2�����ʯ��ʯī��ȼ���ȷֱ�Ϊ395.4kJ/mol��393.5kJ/mol��ͼ2�������ת���������仯ʾ��ͼ��A��ʾ������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������������������Ӧ�ù㷺��
(1)��֪: ��3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H1=a kJ��mol-1��
��2H2(g)+O2(g)=2H2O(1) ��H2=b kJ��mol-1
��H2O(g)=H2O(l) ��H3=c kJ��mol-1
��3Fe(s)+2O2(g))=Fe3O4(s)��H=_________kJ��mol-1(�ú� a��b��c �Ĵ���ʽ��ʾ)��
(2)���������Ǻϳɰ����Ĵ�������ҵ�ϳɰ���ԭ��ΪN2+3H2![]() 2NH3 ��H<0
2NH3 ��H<0
�ٹ�ҵ���á���ѹ��һ��Ϊ20��50MPa���¶�Ϊ 500�档���á��¶�Ϊ 500�桱��Ŀ����____________��
�ڰ����Ǻϳɵ��ʵ���Ҫԭ�ϡ������£�0.1mol��L-1(NH4)2SO4��Һ������Ũ�ȴ�С����Ϊ___________��
�۳����£���a mL c mol��L-1��ˮ�еμ�b mL c mol��L-1ϡ����ǡ������ҺpH=7(��Һ����仯���Բ���)����NH3��H2O�ĵ��볣��Kb=___��
(3)��ҵ�����Ȼ�ԭ��ұ���������ܱ������У�Ͷ�������� FeO ��ĩ��̿�ۣ���һ���¶��·�����Ӧ��FeO(s)+C(s)Fe(s)+CO(g) ��H>0��
�����ݻ��㶨���������������������Ӧ�ﵽƽ��״̬����___________(�����)
A��FeO ��Ũ�Ȳ��ٸı� B��������Է����������ٸı� C�������ܶȲ��ٸı� D�����۵��������ٸı�
���ڸ��¶��£�������Ӧ�ﵽƽ��ʱc(CO)=a mol��L-1����÷�Ӧ��ƽ�ⳣ��Ϊ________�����¶Ȳ���ʱ�����������������ԭ����4������ﵽ��ƽ��ʱ��c(CO)Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪KMnO4��MnO2�����������¾��ܽ�������(Na2C2O4)��������Ӧ�����ӷ���ʽ��2MnO4-+5C2O42-+6H+=2Mn2++10CO2��+8H2O��MnO2+C2O42-+4H+=Mn2++2CO2��+2H2O��
ij�о�С��Ϊ�ⶨij���̿���MnO2������������ʵ�鲽�����£�
ȷ��ȡ1.00g���̿���Ʒ������2.68g Na2C2O4���ټ���������ϡ���Ტ���ȣ����ʲ��μӷ�Ӧ������ַ�Ӧ֮����ȴ����ȥ���ʣ���������Һȫ��ת�Ƶ�250mL����ƿ�в����ݡ�ȡ��25.00mL����Һ������ƿ�У�����0.0200mol��L-1 KMnO4����Һ���еζ���������20.00mL KMnO4��Һʱǡ����ȫ��Ӧ��
(1)0.0200mol��L-1 KMnO4����ҺӦ����______�ζ����У����ʽ����ʽ�������жϵζ��յ��������_______��
(2)����ʵ�����ݼ��㣬���̿���MnO2����������Ϊ________��
(3)�ж���������Բⶨ�����Ӱ�죨�ƫ����ƫС������Ӱ�족��������Һת��������ƿ�У�δϴ���ձ��Ͳ���������ʹ�ⶨ���________����δ��KMnO4����Һ��ϴ�ζ��ܣ���ʹ�ⶨ���________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������غ������Ļ����Һ�У���������ӵ�Ũ��Ϊ0.4mol��L-1������������0.4mol��L-1����������Һʱ�����ɵij���ǡ����ȫ�ܽ⡣��Ӧ����Һ�м����ӵ�Ũ��ԼΪ�� ��
A.0.225mol��L-1B.0.25mol��L-1C.0.45mol��L-1D.0.9mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ����
A. Zn��2HCl===ZnCl2��H2��
B. Ca(ClO)2��2HCl===CaCl2��2HClO
C. Pb3O4��8HCl(Ũ)===3PbCl2��Cl2����4H2O
D. 3Cl2��6KOH(Ũ)![]() 5KCl��KClO3��3H2O
5KCl��KClO3��3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2�����������壬Ҳ����Ҫ�Ļ���ԭ�ϣ���CO2Ϊԭ�Ͽɺϳɶ����л��
��1��CO2����������ϩ����֪��2CO2��g��+6H2��g��![]() CH2=CH2��g��+4H2O��g�� ��H=QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X[X=
CH2=CH2��g��+4H2O��g�� ��H=QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X[X=![]() ]��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
]��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
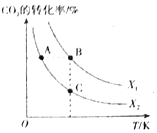
��X1___X2����������������������ͬ����Q___0��
��ͼ��A��B��C�����Ӧ��ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ___��
��2�������£���NaOH��Һ��CO2�����������Խ���̼�ŷţ����ҿɵõ���Ҫ�Ļ�����ƷNa2CO3��
����ij�β���õ�pH=10����Һ������Һ��c��CO![]() ����c��HCO
����c��HCO![]() ��=___[������K1��H2CO3��=4.4��10-7��K2��H2CO3��=5��10-11]��
��=___[������K1��H2CO3��=4.4��10-7��K2��H2CO3��=5��10-11]��
������5LNa2CO3��Һ��23.3gBaSO4����ȫ��ת��ΪBaCO3�������õ�Na2CO3��Һ�����ʵ���Ũ������Ϊ___��[��֪��������Ksp��BaSO4��=1��10-7��Ksp��BaCO3��=2.5��10-6].��������Һ������ı仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100ml 0.5mol/L AlCl3 ������0.5mol/L��NaOH ��Һ�����õ���ɫ����2.65�ˡ�����ȥ��NaOH ��Һ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��3��������ͪ��![]() ��������ҽҩ�м��壬�����л��ϳɡ�������һ�ֺϳ�1��3��������ͪ��·�ߡ�
��������ҽҩ�м��壬�����л��ϳɡ�������һ�ֺϳ�1��3��������ͪ��·�ߡ�

�ش��������⣺
��1���ķ���ʽΪ __________��
��2�����к��й����ŵ�������__________��
��3����Ӧ�ٵķ�Ӧ������________����Ӧ�ڵķ�Ӧ������_______��
��4����Ӧ�ܵĻ�ѧ����ʽ_______��
��5�����������������ҵ�ͬ���칹�干��______�֡�
���ܷ���������Ӧ
������NaHCO3��Һ��Ӧ����1mol��������NaHCO3��Һ��Ӧʱ��������22.4L����״������
д�������ں˴Ź��������з����֮��Ϊ1��6��2��1��һ��ͬ���칹��Ľṹ��ʽ��________��������һ�֣�
��6�������![]() ����ͪ�����Ҵ�������Ϊԭ���Ʊ�
����ͪ�����Ҵ�������Ϊԭ���Ʊ�![]() ��2��4����������ĺϳ�·�ߣ����Լ���ѡ��_______��
��2��4����������ĺϳ�·�ߣ����Լ���ѡ��_______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com