
| A.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数 |
| B.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
| C.达到平衡时,反应速率v正(X)=2v逆(Z) |
| D.平衡常数K值越大,X的转化率越大 |
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源:不详 题型:填空题
 bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。| 压强(kPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2(g)+CO2(g) △H=-372.2KJ/mol达到平衡后,为提高该反应的反应速率和NO的转化率,以下采取的措施正确的是( )
N2(g)+CO2(g) △H=-372.2KJ/mol达到平衡后,为提高该反应的反应速率和NO的转化率,以下采取的措施正确的是( )| A.加催化剂 | B.升高温度 |
| C.加入催化剂同时增大压强 | D.降低温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是| A.降温 | B.减压 | C.减少E的浓度 | D.加压 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OH(g),甲醇生成量与时间的关系如下图所示。
CH3OH(g),甲醇生成量与时间的关系如下图所示。
| A.在300 ℃条件下,t1时刻该反应达到化学平衡 |
| B.在500 ℃条件下,从反应开始到平衡,氢气的平均反应速率v(H2)为nB/(3t1) mol/L |
| C.在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,则氢气的浓度减小 |
| D.由图像说明该反应的正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 eC(g )+dD (g) △H<0下列能证明该反应一定达到平衡状态的是
eC(g )+dD (g) △H<0下列能证明该反应一定达到平衡状态的是查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)
CH3OH(g)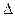 H1
H1 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)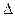 H2
H2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
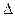 H1 0(填“>”“=”或“<”);
H1 0(填“>”“=”或“<”); 到某时刻测得各组分的浓度如下:
到某时刻测得各组分的浓度如下:| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2C(g),10min后达平衡时,在相同温度
2C(g),10min后达平衡时,在相同温度 下测得容器内混合气体的物质的量是反应前的5/6,试计算
下测得容器内混合气体的物质的量是反应前的5/6,试计算查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 nZ(g)+R(g)达到平衡时,若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,已知t℃时该反应的K=1,则X的转化率为
nZ(g)+R(g)达到平衡时,若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,已知t℃时该反应的K=1,则X的转化率为| A.80% | B.65% | C.45% | D.37% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com