
(8分)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO)
。
2(t-BuNO)
。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K = 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
(3)实验测得该反应的ΔH =" +" 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是 。

(4)结合ΔS推测该反应的在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(8分)(1)
减小
(3)D(4)较高
【解析】
试题分析::(1)当(t-BuNO)2的起始浓度(c0)为0.50mol?L-1时,实验测得20℃时的平衡转化率(α)是65%,
则(t-BuNO)2 2(t-BuNO)
2(t-BuNO)
开始 0.5 0
转化0.5×65% 0.5×65%×2
平衡0.5×(1-65%) 0.5×65%×2
K= 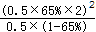 =2.4(mol/L),故答案为:2.4mol/L;
=2.4(mol/L),故答案为:2.4mol/L;
(2)由三段法计算可知,K= 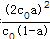 ,温度不变,则K不变,则增大(t-BuNO)2的起始浓度为保证K不变,则转化率a应减小,20℃时该反应在CCl4溶剂中的平衡常数为1.9<2.4,保持(t-BuNO)2起始浓度相同时,由K=
,温度不变,则K不变,则增大(t-BuNO)2的起始浓度为保证K不变,则转化率a应减小,20℃时该反应在CCl4溶剂中的平衡常数为1.9<2.4,保持(t-BuNO)2起始浓度相同时,由K=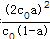 ,则转化率a应小于其在正庚烷溶剂中的平衡转化率,故答案为:减小;小于;
,则转化率a应小于其在正庚烷溶剂中的平衡转化率,故答案为:减小;小于;
(3)由反应的△H=50.5kJ?mol-1,则该反应为吸热反应,则反应物的总能量应小于生成物的总能量,故BC错误;
再由△H=50.5kJ?mol-1,活化能Ea=90.4kJ?mol-1,则反应热的数值大于活化能的数值的一半,故D正确,故答案为:D;
(4)由反应可知,1mol反应物参加反应时生成2mol生成物,则△S>0,再由△H-T△S<0有利于该反应自发进行,
△H>0,则在较高温度下该反应能自发进行,故答案为:>;较高。
考点:用化学平衡常数进行计算 化学反应中能量转化的原因 化学平衡的影响因素 物质的量或浓度随时间的变化曲线
点评:本题考查学生利用化学平衡常数及化学平衡的三段法计算来分析解答,考查知识点较集中,注重对学生基础知识和技能的考查,并训练学生分析图象、画图象的能力。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2(t-BuNO).
2(t-BuNO).

查看答案和解析>>
科目:高中化学 来源: 题型:
 物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向1L正庚烷中加入(t-BuNO)20.50mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1L).下列说法正确的是( )
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向1L正庚烷中加入(t-BuNO)20.50mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1L).下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com