
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。消除汽车尾气中的NO、CO,有利于减少PM2.5 的排放。已知如下信息:
①2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H1=- 748kJ/mol
2CO2(g)+N2(g) △H1=- 748kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-565kJ/mol
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:______________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L 恒容密闭容器中加入0.2moINO 和0.3moICO,在催化剂存在的条件下发生反应①,10min 时反应达到平衡,测得10min 内v(NO)=7.5×10-3mol/(Lmin),则平衡后CO 的转化率为_______________。
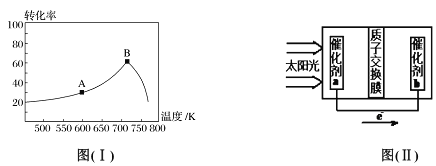
(3)其他条件相同,t min 时不同温度下测得NO 的转化率如图( I)所示。A 点的反应速率v正___(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是_______(填“A”或“B”),理由是__________________。
(4)已知常温下: Ka(HNO2)=7.1×10-4mol/L;Kb(NH3·H2O)=1.7×10-5mol/L。0.1mol/LNH4NO2溶液中离子浓度由大到小的顺序是_________,常温下NO2-水解反应的平衡常数K=____。
(5)人工光合作用能够借助太阳能用CO2和水制备化学原料,图(II )是通过人工光合作用制备HCOOH 的原理示意图,请写出催化剂b处的电极反应式:______________。
【答案】 N2(g)+O2(g)===2NO(g) △H=+183kJ/mol 50% > A 正反应为放热反应,温度升高,平衡向左移动,K变小 c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11 CO2+2e-+2H+=HCOOH
【解析】(1)①2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)△H1=-748kJ·mol-1,
2CO2(g)+N2(g)△H1=-748kJ·mol-1,
②2CO(g)+O2(g)═2CO2(g)△H2=-565kJ·mol-1在一定条件下N2和O2会转化为NO气体,反应的热化学方程式依据盖斯定律计算②-①得到:N2(g)+O2(g)═2NO(g)△H=+183KJ/mol;答案为:N2(g)+O2(g)===2NO(g) △H=+183kJ/mol
(2)结合化学平衡三段式列式计算,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,反应消耗物质的量=7.5×10-3mol·L-1·min-1×10min×2L=0.15mol
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始量(mol)0.3 0.200
变化量(mol)0.150.150.150.075
平衡量(mol)0.150.050.150.075
平衡后CO的转化率为: ![]() 50% 答案为:50%
50% 答案为:50%
(3)NO的转化率开始随温度升高增大,到B点后减小,说明正反应是放热反应,而且B点是平衡状态,则A点是建立平衡的过程,则A点的反应速率:v正>v逆,平衡逆向进行,平衡常数减小,平衡常数较大的是A点。答案为:> 、A、正反应为放热反应,温度升高,平衡向左移动,K变小
(4)由于Ka(HNO2)>Kb(NH3·H2O),根据盐类水解规律,NH4NO2溶液水解显酸性,因此NH4NO2溶液中离子浓度大小为:c(NO2-)>c(NH4+)>c(H+)>c(OH-) ,依据NO2﹣+H2O![]() HNO2+OH﹣,水解平衡常数表达式Kh=
HNO2+OH﹣,水解平衡常数表达式Kh=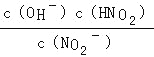 ,分子和分母都乘以氢离子浓度得到水解平衡常数Kh=
,分子和分母都乘以氢离子浓度得到水解平衡常数Kh=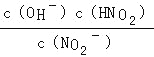 ×
×![]() =
=![]() =
=![]() =1.4×10﹣11. 答案为:c(NO2-)>c(NH4+)>c(H+)>c(OH-)、1.4×10-11
=1.4×10﹣11. 答案为:c(NO2-)>c(NH4+)>c(H+)>c(OH-)、1.4×10-11
(5)催化剂b表面的反应是通入二氧化碳,酸性条件下生成HCOOH,电极反应为:CO2+2e-+2H+=HCOOH,答案为:CO2+2e-+2H+=HCOOH


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 含离子键的晶体不一定是离子晶体 B. 含共价键的晶体一定是分子晶体
C. 只含极性键的分子可能不是极性分子 D. 含非极性键的分子一定是非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃结构简式为(![]() -C≡C-CH=CH-CH3,有关其结构的说法正确的是
-C≡C-CH=CH-CH3,有关其结构的说法正确的是
A. 所有碳原子可能在同一平面上 B. 所有碳原子可能在同一条直线上
C. 最多有18个原子在同一平面上 D. 最多有7个原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.油脂、糖类和蛋白质都能发生水解反应
B.油脂皂化反应可用硫酸作催化剂
C.淀粉溶液中加入硫酸,加热4~5 min,再加入少量银氨溶液,加热,有光亮银镜生成
D.福尔马林能使蛋白质发生变性,可用于浸制动物标本
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组同学用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题
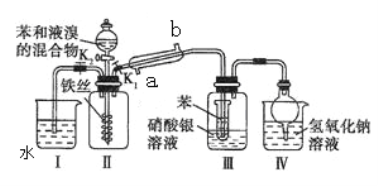
(1)冷凝管所起的作用为冷凝回流蒸汽。冷凝水从________(填a或b)口进入。
(2) 实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。III中小试管内苯的作用是________________________。
(3) 能说明苯与液溴发生了取代反应的现象是___________________。
(4) 反应结束后要使装置I中的水倒吸入装置Ⅱ中.这样操作的目的是________________________________________________________________________________,简述这一操作方法____________________________________________________________________________________________________。
(5)整套实验装置中能防止倒吸的装置有________(填装置序号)。
(6) 将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液;④加入无水CaCl2粉末干燥;
⑤__________________________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 LCO和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ④⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1 mol/L醋酸钠溶液,下列说法正确的是
A. 加少量水稀释时,![]() 增大
增大
B. 向其中再加入少量醋酸钠晶体时,溶液中所有离子浓度都增大
C. 离子浓度大小比较:c(CH3COO-) >c(Na+) >c(OH-) > c(H+)
D. 向其中加入盐酸至恰好呈中性时,c(Na+) = c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
①标准状况下,1LHCl和1LH2O的物质的量相同;
②标准状况下,11.2 LH2和14gN2所含原子数相同;
③28gCO 的体积约为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. ⑤⑥ B. ②③⑤⑥ C. ②⑤⑥ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)= 2H2O(g) ΔH=-483.6 kJ·mol-1
②H2(g) + S(g) = H2S(g) ΔH=-20.1 kJ·mol-1 。下列判断一定正确的是
A. 1 mol氢气完全燃烧生成H2O(g)吸收241.8 kJ热量
B. 水蒸气和硫化氢的能量相差221.7 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. 反应②中改用固态硫,1 mol H2完全反应放热将小于20.1 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com