
实验室里需用480 mL 0.10 mol·L-1 CuSO4溶液,现选用500 mL容量瓶进行配制,以下操作正确的是
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾配制500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g 胆矾配制500 mL溶液
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:2014高考名师推荐化学元素周期律及其应用(解析版) 题型:选择题
下列说法正确的是
A.电子层结构相同的不同离子,其半径随核电荷数增大而减小
B.C、O、S原子半径依次增大,氢化物稳定性逐渐增强
C.ⅠA族元素与ⅦA族元素形成的化合物都为离子化合物
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应的水化物酸性越强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学NA与粒子(解析版) 题型:填空题
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1) △H1= -195kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2H2O △H2= -534.2kJ·mol-1
写出肼和N2H4反应的热化学方程式 ;
(3)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:选择题
有关AgCl的沉淀溶解平衡的说法正确的是
A.AgCl沉淀生成和溶解同时在不断进行,且速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.用等体积的蒸馏水和0.01mol·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成的AgCl的损失小于用稀盐酸洗涤的损失量。
D.向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:选择题
已知25℃,Fe(OH)3(s) Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O
Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
A.Ksp·Kh=Kw3 B.Ksp·Kw=Kh
C.Kh/Kw=Ksp D.Kw/Kh=Ksp3
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+物质的量浓度(mol·L-1)为
A. B.
B. C.
C.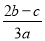 D.
D.
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:简答题
【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为 ;
(2)AB32-的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为 ,1mol B22+中含有的π键数目为 。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键 。
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为a g/cm3,则晶胞的体积是 (只要求列算式,阿伏加德罗常数的值为NA)

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:简答题
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:

(一定条件下,MnO4- 可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是 ;
(2)检验滤液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的 ;调节溶液的pH为3.2的目的是 。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 ,写出其反应方程式 ;
③Ⅲ中加入MnSO4的目的是 。
(4)从多次循环使用后母液中可回收的主要物质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
从化工厂铬渣中提取硫酸钠的工艺如下:
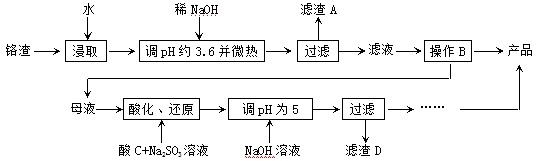
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+ ;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5mol·L-1)时pH分别为3.6和5。
;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以 ,滤渣A为 (填化学
式)。
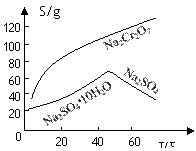
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填
字母序号)
A.蒸发浓缩,趁热过滤 B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为:
;酸C为 ,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 。
(4)根据2CrO42-+2H+  Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com