
 )是一种环保型的新涂料,其合成路线如下图所示:
)是一种环保型的新涂料,其合成路线如下图所示:
 ,E是高分子化台物,其结构简式为
,E是高分子化台物,其结构简式为 ;
; $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;
+H2O; (写出其中一种的结构简式).
(写出其中一种的结构简式).分析 对比结构可知,反应①发生醇的消去反应,由P的结构,逆推可知D为 ,进一步反推C为
,进一步反推C为 、B为
、B为 ,A为
,A为 ,由B生成E的反应条件及E是高分子化合物,可知E为
,由B生成E的反应条件及E是高分子化合物,可知E为 .对比结构可知,反应①发生醇的消去反应,还一生成另外一种烯烃:
.对比结构可知,反应①发生醇的消去反应,还一生成另外一种烯烃: .
.
(4)由①能与NaHCO3 溶液反应,可知结构中含有-COOH;②遇 FeCl3溶液显紫色,可知结构中含有苯环且苯环上含有一个-OH,结合③分子中含一个-CH3,可知苯环侧链有以下几种情况:有2个侧链,为-OH、-CH(CH3)COOH,有邻、间、对三种位置;有3个侧链,为-OH、-CH3、-CH2COOH,或者为-OH、-CH2CH3、-COOH,采取定二移一法确定同分异构体数目;
解答 解:由P的结构,逆推可知D为 ,进一步反推C为
,进一步反推C为 、B为
、B为 ,A为
,A为 ,由B生成E的反应条件及E是高分子化合物,可知E为
,由B生成E的反应条件及E是高分子化合物,可知E为 .
.
(1)D为 ,其分子式为C15H12O2,对比结构可知,反应①发生醇的消去反应,
,其分子式为C15H12O2,对比结构可知,反应①发生醇的消去反应,
故答案为:C15H12O2;消去;
(2)若反应②中两种反应物物质的量之比为1:1,结合A的结构可知为碳碳双键发生断裂生成醛,外另一种产物为HCHO,其电子式为 ,由上述分析剧增,高分子化合物E的结构筒式为
,由上述分析剧增,高分子化合物E的结构筒式为 ,
,
故答案为: ;
; ;
;
(3)B转化为C的化学方程式是: $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O,
+H2O,
故答案为: $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;
+H2O;
(4)由①能与NaHCO3 溶液反应,可知结构中含有-COOH;②遇 FeCl3溶液显紫色,可知结构中含有苯环且苯环上含有一个-OH,结合③分子中含一个-CH3,可知苯环侧链有以下几种情况:有2个侧链,为-OH、-CH(CH3)COOH,有邻、间、对三种位置;有3个侧链,为-OH、-CH3、-CH2COOH,或者为-OH、-CH2CH3、-COOH,其中2个取代基有邻、间、对3种位置,对应的另外1个取代基分别有4、4、2种位置,每种情况有10种,故共有23种,其中核磁共振氢谱中有6组峰的其中一种的结构简式为: 等,
等,
故答案为:23; .
.
点评 本题考查有机物的推断,根据P的结构及反应条件,利用逆推法进行推断,综合考查学生分析推理、知识迁移应用能力,是高考常见题型,难度中等.


科目:高中化学 来源: 题型:解答题

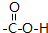 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取8.0 g CuSO4,加入500 mL水 | |
| B. | 称取7.68 g CuSO4,加入480 mL水 | |
| C. | 称取12.5 g CuSO4•5H2O,加水配成500 mL溶液 | |
| D. | 称取12.0 g CuSO4•5H2O,加水配成480 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Fe+4H2O(g)═Fe3O4+4H2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2? | D. | Cl2+2H2O═HClO+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以${\;}_{10}^{20}$Ne和${\;}_{10}^{22}$Ne的中子数相同,所以${\;}_{10}^{20}$Ne和${\;}_{10}^{22}$Ne互为同位素 | |
| B. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 | |
| C. | 二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 | |
| D. | C2H6分子中既含极性键又含非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L的 Na2S溶液中S2-的个数为0.1NA | |
| B. | 标准状况下,11.2LH2所含的中子数为0.15 NA | |
| C. | 7.8g Na2O2与足量的水反应,转移的电子数为0.2 NA | |
| D. | 1mol羟基所含电子数为9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
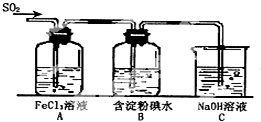 某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com