
【题目】科学家合成出了一种新化合物(如图所示),其中M、W、T、L为同一短周期元素,L核外最外层电子数是W核外电子数的一半。下列叙述正确的是
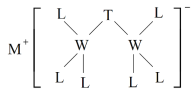
A.化合物ML属于离子化合物,也属于弱电解质
B.该新化合物中T满足8电子稳定结构
C.W的最高价氧化物可以与水反应生成弱酸
D.元素非金属性的顺序为W>T>L
【答案】B
【解析】
M、W、T、L为同一短周期元素,根据图知,W能形成4个共价键、L能形成1个共价键,则W位于第IVA族、L位于第VIIA族,且L核外最外层电子数是W核外电子数的一半,L最外层7个电子,则W原子核外有14个电子,故W为Si元素,L为Cl元素;该阴离子中Cl元素为﹣1价、W元素为+4价,根据化合价的代数和为﹣1价可知,T为﹣3价,所以T为P元素;根据阳离子所带电荷知,M为Na元素,据此解答。
通过以上分析知:M、W、T、L分别为Na、Si、P、Cl元素。
A.NaCl为离子化合物,但属于强电解质,故A错误;
B.结合分析可知,该化合物中P为﹣3价,P原子最外层电子数为5+3=8,满足8电子稳定结构,故B正确;
C.Si的最高价氧化物为SiO2,SiO2不与水反应,故C错误;
D.同一周期元素非金属性随着原子序数增大而增强,则非金属性Cl>P>Si,即非金属性:L>T>W,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
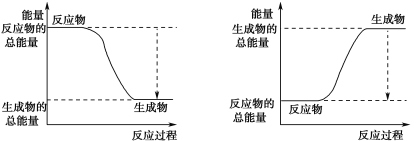
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,在元素周期表中处于如图位置的元素性质往往相似。由此推测下面有关锂及其化合物的性质的叙述错误的是( )
A.锂在过量氧气中燃烧,主要产物是Li2O而不是Li2O2
B.在相同温度下,溶解度Li2CO3小于LiHCO3
C.Li2CO3受热很难分解
D.少量的锂保存在石蜡中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组欲探究SO2的化学性质,设计了如下实验方案。
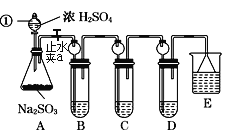
(1)指出仪器①的名称:___。
(2)装置B检验SO2的氧化性,则B中所盛试剂可以为___。
(3)装置C中盛装溴水用以检验SO2的___性,则C中反应的离子方程式为___。
(4)装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为___;
假设三:该白色沉淀为上述两种物质的混合物。
②基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的试剂:0.5mol·L-1HCl、0.5 mol·L-1H2SO4、0.5mol·L-1BaCl2、1mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:___。
第2步,用另一只干净试管取少量沉淀样品,加入___(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有___的试管中。若出现固体完全溶解,出现气泡,且该溶液褪色现象,则假设一成立。
(5)装置E中盛放的试剂是__,作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2辅助的Al—CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。该电池多孔碳电极的反应式为: 6O2 + 6e = 6O2 6CO2+6O2 = 3C2O42+6O2。该装置工作时下列说法不正确的是
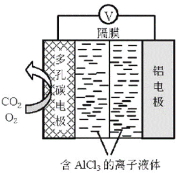
A.多孔碳电极有利于气体扩散至电极表面
B.铝电极为上的电势比多孔碳电极上的高
C.反应过程中O2的作用是催化剂
D.该电池的总反应式为:2Al+6CO2=Al(C2O4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔在不同条件下可以转化成许多化合物,如图所示,下列叙述正确的是( )
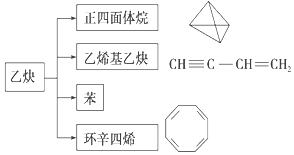
A. 正四面体烷的二氯代物只有1种
B. 乙炔生成乙烯基乙炔是取代反应
C. 由乙炔制得的四种有机物的含碳量不同
D. 苯乙烯与环辛四烯分子式不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废旧锂电池材料含有钴酸锂(LiCoO2)、导电剂石墨和铝粉等。回收废旧锂电池中钴的工艺流程如下:
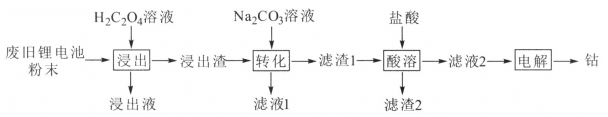
已知:Ksp(CoC2O4)=6.0×10-8,Ksp(CoCO3)=1.5×10-13。
回答下列问题:
(1) LiCoO2中,Co元素的化合价为______________。
(2)“浸出液”的主要成分是LiHC2O4、Al(HC2O4)3,“浸出渣”的主要成分是CoC2O4。“浸出”中生成CoC2O4的化学方程式为__________,若H2C2O4用量过大,CoC2O4的产率反而会降低,原因是____。
(3)“转化”中加入Na2CO3溶液发生反应的离子方程式为______________,该反应进行的程度较大,试通过计算其平衡常数K并解释原因______________。
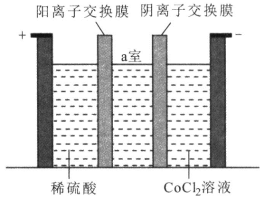
(4)“电解”时装置如图所示。阳极的电极反应式为_______,电解后a室中的电解液可返回工序继续使用。
(5)某废旧锂电池粉末中LiCoO2的质量分数为49%,将50吨该废料进行回收利用,电解得到钴5.9吨,则钴的回收率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体有单质、二元化合物、三元化合物等之分,其中三元半导体CuAlO2(或Cu2Al2O4)的制取,常采用CuO与Al2O3或Al(OH)3共热的方法。试分析并回答:
(l)试完成如下化学方程式:
_______CuO+_______ Al2O3![]() _______Cu2Al2O4+_______ ↑
_______Cu2Al2O4+_______ ↑
(2)上述反应能发生的理由主要是_____________。
(3)Al(OH)3有碱式和酸式两种电离方式,若25℃时,其酸式电离为Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-
AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-![]() AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
(4)经实验测定,“AlO2-” 的形式应该是[Al(OH)4]-,则AlCl3溶液与Na[Al(OH)4]溶液作用的离子方程式是_________________。
(5)用石墨电极电解Na[Al(OH)4] 溶液是制取高品质用Al(OH)3的方法之一。该电解反应的离子方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过____方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
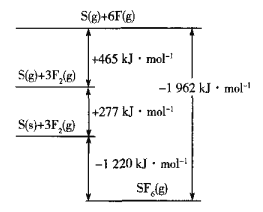
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
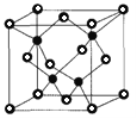
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com