
实验室中用锌和稀硫酸反应制取氢气。
(1)要制取3.36L(标准状况)气体,需要1 mol/L H2SO4多少毫升?
(2)某同学用向下排空气法收集氢气,测得所收集气体密度是纯氢气密度的1.2倍。求该气体中氢气所占的体积分数(设空气的平均相对分子质量为29)。
(1)150毫升
(2)96.3%。
解析试题分析:(1)要制取3.36L(标准状况)气体,需要1 mol/L H2SO4多少毫升?
解: Zn+ H2SO4=ZnSO4+ H2↑ (2分)
1 mol 22.4L
n(H2SO4) 3.36L (1分) (1分)
(1分) mol (1分)
mol (1分)
0.15L×1000mL/L="150" mL (1分)
答:需要1 mol/L H2SO4150毫升
(2)某同学用向下排空气法收集氢气,测得所收集气体密度是纯氢气密度的1.5倍。求该气体中氢气所占的体积分数(设空气的平均相对分子质量为29)。
解:根据
 (2分)
(2分)
设amol氢气中混有bmol空气。
则: (2分)
(2分)
解得a:b=26:1 (1分)
V(H2)%=n(H2)%= =96.3% (1分)
=96.3% (1分)
答:该气体中氢气所占的体积分数为96.3%。
考点:考查物质的量在化学计算中的应用。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:填空题
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。
(1)现有一种无色的鲜花营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。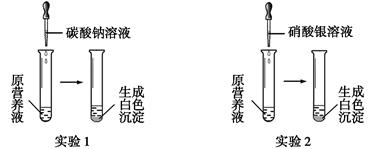
根据以上实验,请你填空。
①由实验1可确定原营养液中一定没有的物质是 (填化学式),写出生成白色沉淀的离子方程式是 。
②若测得原营养液中K+、Cl-的数目之比为2∶1,则原营养液是由 种溶质配制成的。
③某同学用氯化钙、硝酸钾、氯化钾配成的营养液中K+、Cl-、NO3-的数目之比为2∶5∶1,
则所用硝酸钾和氯化钙的物质的量之比是 。
(2)下表是500mL某“鲜花保鲜剂”中含有的成分,阅读后回答下列问题。
| 成分 | 质量(g) | 摩尔质量(g ·mol-1) |
| 蔗糖 | 68.4 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将0.1 mol的镁和铝的混合物溶于50 mL 4 mol·L-1 H2SO4溶液中,然后再滴加2 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=80 mL时,计算金属粉末中镁的物质的量及V2的体积。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,计算滴入NaOH溶液的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知Mg能在CO2气体中燃烧(CO2+2Mg  2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
求:(1)在足量CO2气体中,反应结束后所得固体的质量。
(2)在CO2和O2的混合气体中,反应后O2有剩余,则最终固体的质量为_______克。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知反应:SO2+Cl2+2H2O=2HCl+H2SO4,若反应过程中消耗SO2标准状况下2.24L,
则:(1)求转移电子的数目。
(2)反应后溶液中H+的物质的量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将5.0g碳酸钙放入一定量稀盐酸中恰好完全反应,得到40mL密度为1.32g/mL的溶液。试计算:
(1)生成标准状况下的二氧化碳气体多少升?(不考虑CO2在水中的溶解)
(2)所得溶液中氯化钙的物质的量浓度。
(3)所用稀盐酸的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将32g铜与600 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:标况下,NO和NO2的体积各为多少L?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某一种胃药中的抑酸剂为碳酸钙,其中所含的抑酸剂质量的测定如下:
①需配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液
②取一粒(药片质量相同) 0.2 g的此胃药片,磨碎后加入20.0 mL蒸馏水
③以酚酞为指示剂,用0.1 mol·L-1的NaOH溶液滴定,用去V mL达滴定终点
④加入25 mL 0.1 mol·L-1的HCl溶液
(1)写出实验过程的步骤(写编号顺序) 。
(2)下图所示容器中配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液肯定不需要的仪器是(填序号) ,配制上述溶液还需要的玻璃仪器是 (填仪器名称)。 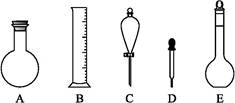
(3)配制上述溶液应选用的容量瓶规格是(填字母) 。
| A.50 mL 50 mL |
| B.100 mL 100 mL |
| C.100 mL 150 mL |
| D.250 mL 250 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com