
| A. | 和4He是同一种原子 | B. | 比4He少一个质子 | ||
| C. | 是4He的同位素 | D. | 比4He多一个中子 |
分析 元素符号的左上角表示质量数,左下角表示质子数,原子序数=质子数,中子数=质量数-质子数;
同位素指质子数相同,中子数(或质量数)不同的同一元素的不同原子.
同一种原子的质子数相同.
解答 解:A.3He和4He的质量数不同,不是同一种原子,故A错误;
B.3He与4He都属于氦元素,质子数均为2,故B错误;
C.3He与4He质子数相同,质量数不同,是氦元素的不同核素,互为同位素,故C正确;
D.3He的中子数为3-2=1,4He的中子数为4-2=2,3He比4He少一个中子,故D错误.
故选C.
点评 本题考查原子符号、原子构成中微粒之间的关系、同位素与同分异构体等,难度不大,注意把握同位素、同分异构体、同系物、同素异形体的概念内涵与外延.


科目:高中化学 来源: 题型:解答题
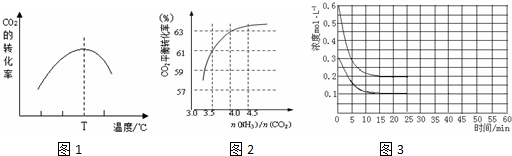
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加活性炭吸附水中小顆粒物,净化水质的方法属于物理方法 | |
| B. | 医用消毒洒精中乙醇的浓度为95% | |
| C. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,“硝“是指硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
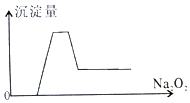 有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )| A. | ①②③④⑦ | B. | ①③④⑦ | C. | ①②③⑤⑦ | D. | ①③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
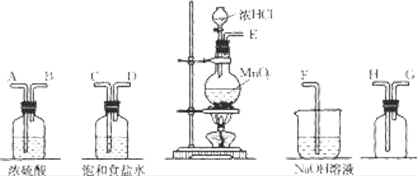
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该工艺中MgO可循环利用 | |
| B. | 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L | |
| C. | 在800~1000℃条件下,O2的还原性强于Cl2的还原性 | |
| D. | 若反应2NH3+MgCl2+H2O═2NH4Cl+MgO能自发进行,则该反应△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
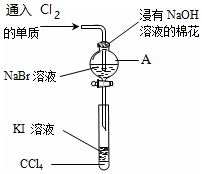 为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验,
为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L乙醇中碳氢键的数目为0.5 NA | |
| B. | 1 L 0.1 mol•L-1硫酸钠溶液中含有的氧原子数为0.4 NA | |
| C. | 0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1 NA | |
| D. | 0.1 mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com