
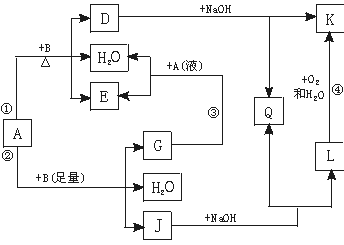
 图中单质可能为( )
图中单质可能为( )| A.C | B.Fe | C.Al | D.Cu |
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.45mL | B.50mL | C.40mL | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
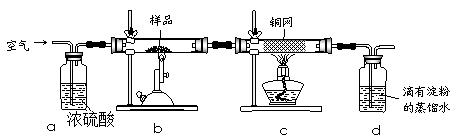
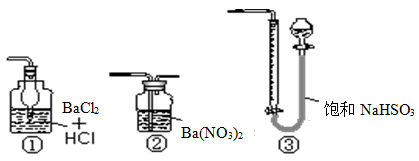
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 实验操作 | 预期现象 | 结论 |
| 取少量褪色后的溶液, | | 说明假设一是合理的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
| C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
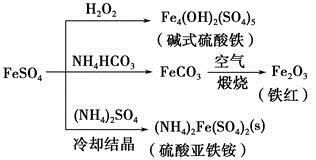
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.②⑤ | D.④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变 |
| B.往溶液中滴入无色KSCN溶液,显黄色 |
| C.Fe2+和Fe3+的物质的量之比为6:1 |
| D.氧化产物与还原产物的物质的量之比为2:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com