
 碳及其化合物应用广泛.
碳及其化合物应用广泛. (2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
(2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 0.200 | 0.160 | 0.125 | 0.099 | 0.080 | 0.080 |
| n(H2O)/mol | 0.300 | 0.260 | 0.225 | 0.199 | 0.180 | 0.180 |
分析 (1)硅原子时14号元素,原子中核电荷数为14,依据原子核外电子排布规律书写原子结构示意图;
(2)由图表数据可知,反应在4min达到平衡,列三段式,依据平衡常数概念计算化学平衡常数K;
(3)计算注人1m o l CO、1mol H2O (g),2molCO2和2mo1H2的浓度商,和该温度的平衡常数比较分析判断反应进行的方向;
(4)依据热化学方程式和盖斯定律计算得到所需让热学方程式;
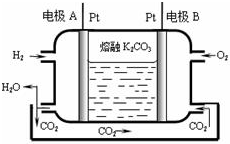
(5)分析装置图是氢氧燃料电池,电解质为碳酸钾熔融盐,传导离子为碳酸根离子;依据原电池原理可知电极A为负极,氢气失电子在碱溶液中生成水,B为正极氧气得到电子生成氢氧根离子;
(6)依据原电池和电解池中电极反应和电子守恒得到物质的定量关系进行计算.
解答 解:(1)硅原子核电荷数为14,原子结构示意图为: ,
,
故答案为: ;
;
(2)由图表数据可知,反应在4min达到平衡,
CO(g)+H2O(g)$\stackrel{沸石分子筛}{?}$CO2(g)+H2(g)
c始:0.2 0.3 0 0
c转:0.12 0.12 0.12 0.12
c平:0.08 0.18 0.12 0.12
则化学平衡常数K=$\frac{0.12×0.12}{0.08×0.18}$=1;
故答案为:1;
(3)温度不变,K不变,相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2mol CO2和2mol H2,此时浓度商Qc=$\frac{2×2}{1×1}$>K=1,反应逆向进行,此时v(正 )<v(逆);
故答案为:<;
(4)已知①CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-141kJ•mol-1
②2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
③CH3OH(l)+$\frac{3}{2}$O2(g)?CO2(g)+2H2O(g)△Hl=-726kJ•mol-1'
依据盖斯定律①+②-③得到CO(g)+2H2(g)=CH3OH(l)△H=+101 kJ/mol,
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=+101 kJ/mol;
(5)装置图是氢氧燃料电池,电解质为碳酸钾熔融盐,传导离子为碳酸根离子;依据原电池原理可知电极A为负极,氢气失电子在碱溶液中生成水,A电极反应为:H2-2e-+CO32-=CO2+H2O;B为正极氧气得到电子生成氢氧根离子O2+2H2O+4e-=4OH-;
故答案为:H2-2e-+CO32-=CO2+H2O;
(6)电池电解饱和食盐水,阳极生成0.2mol Cl2,电极反应2Cl--2e-=CL2↑,原电池中B为正极氧气得到电子生成氢氧根离子O2+2H2O+4e-=4OH-,依据电子守恒得到氯气和氧气的定量关系:2CL2~O2 ,生成氧气0.1mol,则至少需通人O2的体积标准状况下为2.24L,
故答案为:2.24.
点评 本题考查了化学平衡常数概念、原电池电极反应、电解池电子守恒的计算、原子结构的分析判断,化学平衡影响因素和计算的理解应用,掌握基础是解题关键,题目难度中等.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH、FeSO4在空气中放置变质 | B. | 氯水、AgI密封保存在棕色试剂瓶中 | ||
| C. | 乙烯使溴水和酸性KMnO4溶液褪色 | D. | 常温下浓硝酸不能溶解Al和Au(金) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列各组物质中,不满足如图所示转化关系的是( )
下列各组物质中,不满足如图所示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 戊 |
| A | NH3 | Cl2 | N2 | H2 |
| B | Fe | H2O | Fe2O3 | CO |
| C | Al(OH)3 | NaOH | NaAlO2 | CO2 |
| D | Br2 | FeCl2 | FeBr3 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol 放出热量9.2KJ时,转移电子0.6 NA | |
| B. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| C. | 标准状况下,11.2L苯中含有碳氢键的数目为3NA | |
| D. | 0.1mol H2O2分子中含极性共价键数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com