
【题目】关于电解槽的叙述不正确的是( )
A. 是电能转变成化学能的装置B. 与电源正极相连的是阳极
C. 阴极失去电子,发生氧化反应D. 参与电解的阳离子移向阴极
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图①是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理。下列说法正确的是( )

A. 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图②的电解池中,有0.084g阳极材料参与反应,阴极会有336mL的气体产生(标况)
C. 图①中发生的还原反应是:Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D. 若图①中3.6g镁溶解产生的电量用以图②废水处理,理论可产生10.7g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
Ⅰ.(1)铁元素在周期表中的位置为___________。
(2)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是___________ (填字母)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
Ⅱ.下图是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、SiO2)为原料制备高纯氧化铁的生产流程示意图:

回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是 ___________ 。
(2)煅烧FeCO3生成产品Ⅰ的化学方程式为___________。
(3)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为 ___________ 。

(4)写出步骤Ⅳ反应的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据有关媒体报道,美国华裔科学家叶军领导一个研究小组成功制造出全球最准确的时钟,两亿年误差不足一秒。它是一个锶原子钟,比铯原子喷泉钟准确得多,估计将可大大促进不同的电讯网络的发展,将使全球各地的船只导航变得更为准确。请根据锶、铯在元素周期表中的位置,推断下列内容:
(1)锶元素属于________(填“金属”或“非金属”)元素,金属性比钙元素________(填“强”或“弱”),锶原子的核内质子数为________,原子核外有________个电子层,其原子结构示意图为________,其原子半径________镁(填“大于”、“小于”或“等于”);铯的原子核外共有________层电子,最外层电子数为________。
(2)铯与水起剧烈反应,放出________色气体,同时使滴有紫色石蕊试液的溶液显________色,因为______________________(写出化学方程式)。
(3)碳酸锶是________色粉末,与盐酸反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取CoC12·6H2O粗品的工艺流程图如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、A13+等;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
请回答下列问题:
(1)上述工艺流程图中操作a的名称:_______________。
(2)写出“浸出”时Co2O3发生反应的离子方程式:____________________。
(3)加入NaC1O3的作用是________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。使用萃取剂最适宜的pH范围是_________(填字母序号)。
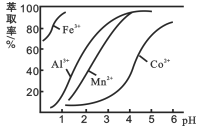
A.2.0~2.5 B. 3.0~3.5 C. 5.0~5.5 D. 9.5~9.8
(5)“除钙”“镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11, Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿[主要成分MnO2,还含SiO2 、Fe2O3、Al2O3、Cu2(OH)2CO3的等杂质]和酸洗厂废酸液(含1mol/LH2SO4的FeSO4溶液)联合生产硫酸锰和铁红(Fe2O3)生产过程如下

Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | |
开始沉淀时 | 8.3 | 6.3 | 4.7 | 3.4 | 2.7 |
完全沉淀时 | 9.8 | 8.3 | 6.7 | 4.4 | 3.2 |
(1)含杂质的软锰矿使用前需将其粉碎,目的是______。
(2)滤渣1中含有的主要物质是_______。
(3)滤液1中,加氨水调控溶液pH至3.2,通入O2,反应的离子方程式是_______。若用H2O2代替O2,是否合理?理由是___________。
(4)软锰矿粉与硫酸和硫酸亚铁溶液反应的离子方程式是_________。
(5)滤液3中加入难溶电解质MnS的目的是(用离子方程式表示)_________。
(6)用重结晶法从滤液4中获取硫酸锰晶体的操作是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、NH3、CO2为原料先制得NaHCO3,进而生产出纯碱。回答下列问题:
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)装置甲中用稀盐酸与CaCO3反应制备CO2,发现CaCO3与试管内的稀盐酸不能接触,在加稀盐酸时,发现试剂瓶中的稀盐酸已用完,为使反应能顺利进行,可向长颈漏斗中加入的试剂是______________。
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(2)乙装置中的试剂是______________;丁装置中稀硫酸的作用是______________。
(3)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从______________管通入 __________气体。
(4)有同学建议在戊装置的b管下端连接己装置,理由是______________ 。
(5)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水):
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:______________。
(6)根据侯氏制碱原理制备少量NaHCO

(7)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是 ______________ (填字母)。
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3、SiO2和Fe2O3等。从铝土矿中提炼Al2O3的流程如下:
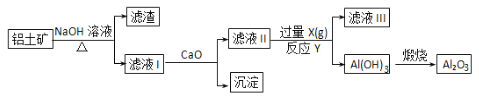
下列说法中错误的是 ( )
A. 滤液Ⅰ的主要成分是Na2SiO3、NaAlO2和NaOH
B. 滤液Ⅲ的含大量的阴离子是HCO3-
C. 反应Y的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 滤液Ⅱ中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,书写正确的是
A.KNO3=K++NO3ˉB.NaHSO4=Na+ +HSO4ˉ
C.Na2SO4=Na2+ +SO42ˉD.KClO3=K++Cl-+3O2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com