

| A����������ˮͨ��SO2����ʱ��pH��SO2���ʵ����Ĺ�ϵͼ |
| B��������c(H+)��ͬ�Ĵ�����������ˮʱ��c(H+)��ˮ����Ĺ�ϵͼ |
| C�����³�ѹ�£���2b mol CO2����ͨ��1L bmol��L-1��NaOH��Һ�У�����CO2�����ͨ�룬��Һ����ˮ�������c��H���������ͼ�仯��ϵ |
| D������������Һ�еμ�ϡ����õ���pH��5�Ļ����Һ�У�c(Na��)��c(NO3��) |


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH=2��������c(H+)��c(Cl��) + c(OH��) |
| B��pH=3�Ĵ����У�c(H+)��3.0 mol��L��1 |
| C��pH=2��������pH=3�Ĵ��������ʵ����ʵ���Ũ��֮��Ϊ10:1 |
| D��pH=3�Ĵ�����pH=11��NaOH��Һ��������������Һ�У�c(Na+)��c(CH3COO��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ͨ��CO2����ҺpH��С |
B������NaOH���壬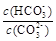 ���� ���� |
| C����ˮ�����c(OH-) = 1��10-10 mol.L-1 |
| D����Һ�У�c(CO32-)>c(OH-)>c(HCO3-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��HA��ǿ�� |
| B���û��ҺpH=7 |
| C��ͼ��x��ʾHA��Y��ʾOH-��Z��ʾH+ |
| D���û����Һ�У�c(A-)+c(Y)=c��Na+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��ϡ�����ܽ�ʯ��ʯ�����ӷ���ʽΪ CaCO3��2H����Ca2+��H2O��CO2�� |
| B��ϡ�����ˮϡ�ͺ���Һ��c(CH3COO��)/c(CH3COOH)��� |
| C����ϡ�����м����Ũ�ȵ�NaOH��Һ�����������仯����ͼ |
| D��CH3COONH4��Һ��K2SO4��Һ�������ԣ�����Һ��ˮ�ĵ���̶���ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ϡ������ c(H+)��c(Cl��)��c(OH��) |
B�������£���0.1mol/L��HNO3��Һ����ˮ�������c(H+)��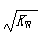 |
| C����Na2CO3ˮ��Һ���ȡ����ɣ����õ�NaOH���� |
| D���������ȫ�кͣ�������Һ��pH���ܴ���7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 N2��g��+3H2��g����
N2��g��+3H2��g����| ʱ��t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| ��ѹǿp 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��0.2 mol��L��1��ˮ�У�c(OH��)��c( )��� )��� |
| B��10 mL 0.02 mol��L��1 HCl��Һ��10 mL 0.02 mol��L��1 Ba(OH)2��Һ��ֻ�ϣ�����Ϻ���Һ�����Ϊ20 mL������Һ��pH��12 |
| C��0.1 mol/L��Na2S��Һ�У�c(OH��)��c(H��)��c(HS��)��c(H2S) |
| D��pH��3��һԪ���pH��11��һԪ��������ͺ����Һ��һ����c(OH��)��c(H��) |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com