
【题目】氨基甲酸铵(H2 NCOONH4)是一种白色晶体,是常见的实验药品,可由干燥的NH3和干燥的CO2在任何比例下反应得到每生成1.0g氨基甲酸铵放出2.05kJ的热量。回答下列问题:
(1)实验室可选用下列装置(I~V)制备干燥的NH3和CO2。
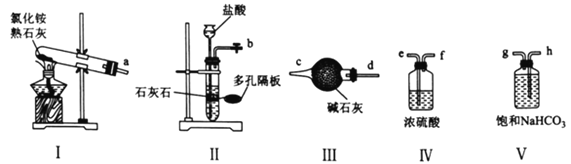
①用装置I、Ⅲ制备并纯化NH3时,接口a与________________(填接口字母)相连,装置I中发生反应的化学方程式为________________________。
②制备并纯化CO2时,按气流从左至右的方向,各接口连接顺序为________________(填接口字母)
(2)一种制备氨基甲酸铵的改进实验装置如下图所示:

①用仪器W代替分液漏斗的优点是________________________;用干冰装置代替(1)中制备并纯化CO2装置的优点是________________________。
②“薄膜反应器”中发生反应的热化学方程式为________________________;盛浓硫酸的装置的作用是________________________________(列举2点)。
③体系中若有水蒸气,还可能生成的铵盐是________________________(填化学式)。
【答案】d 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O bhgef 平衡压强,可使浓氨水一直顺利滴入三颈烧瓶 装置简单,产生的CO2不需净化和干燥(或气体的温度低有利于提高NH3和CO2的平衡转化率,答案合理即可 2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1 吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等(答出两条合理的优点即可 (NH4)2CO2(或NH4HCO3)
CaCl2+2NH3↑+2H2O bhgef 平衡压强,可使浓氨水一直顺利滴入三颈烧瓶 装置简单,产生的CO2不需净化和干燥(或气体的温度低有利于提高NH3和CO2的平衡转化率,答案合理即可 2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1 吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等(答出两条合理的优点即可 (NH4)2CO2(或NH4HCO3)
【解析】
根据装置图中各仪器的构造和作用分析解答;由题干信息计算反应热,进而书写热化学方程式。
(1)①为了使气体充分干燥,气体从大口通入,应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,
故答案为:d,2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②制备并纯化CO2时,先通过饱和碳酸氢钠溶液除去氯化氢,然后通入浓硫酸干燥,所以按气流从左至右的方向,各接口连接顺序为bhgef,
故答案为:bhgef;
(2) ①根据图中装置的构造可知,用仪器W代替分液漏斗的优点是:平衡压强,可使浓氨水一直顺利滴入三颈烧瓶;用干冰装置代替(1)中制备并纯化CO2装置的优点是:装置简单,产生的CO2不需净化和干燥,
故答案为:平衡压强,可使浓氨水一直顺利滴入三颈烧瓶;装置简单,产生的CO2不需净化和干燥;
②生成1.0g氨基甲酸铵放出2.05kJ的热量,则生成1mol放出的热量为159.90kJ,所以热化学方程式为:2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1;盛浓硫酸的装置的作用是:吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等,
故答案为:2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1;吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等;
③体系中若有水蒸气,可与二氧化碳反应生成碳酸,碳酸与氨气反应生成盐,所以还可能生成的铵盐是(NH4)2CO2(或NH4HCO3),
故答案为:(NH4)2CO2(或NH4HCO3)。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.一定条件下可以用H2除去乙烷中混有的乙烯
B.苯和四氯化碳都能萃取溴水中的溴
C.乙醇、乙酸和乙酸乙酯三者的混合液可用分液的方法分离
D.甲烷、乙烯和苯在工业上都可通过石油分馏得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,发生反应3A(g)+B(g)![]() 2Z(g),若最初A的物质的量浓度是2mol/L,测得10s内A的平均反应速率υ(A)=0.15mol/(Ls),则反应进行到10s时容器中A的物质的量浓度是
2Z(g),若最初A的物质的量浓度是2mol/L,测得10s内A的平均反应速率υ(A)=0.15mol/(Ls),则反应进行到10s时容器中A的物质的量浓度是
A. 3mol/L B. 1.2 mol/L C. 0.5mol/L D. 3.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
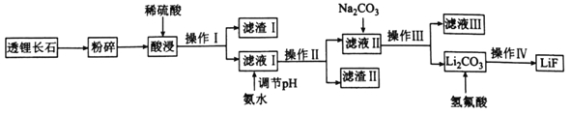
【题目】氟化锂(LiF)难溶于水,可用于核工业、光学玻璃制造等。以透锂长石(含Li2O、Al2O3、SiO2)为原料制备氟化锂的工艺流程如下:
回答下列问题:
(1)滤液I中含有的金属离子有________,滤渣I的一种用途是________________。
(2)滤渣Ⅱ是目前应用最广泛的无机阻燃剂,写出生成滤渣Ⅱ的离子方程式:________________。常温下,若向滤液I中滴加氨水调节pH=5时,溶液中c(Al3+)=________mol·L-1,则溶液中A13+________(填“是”或“否”)沉淀完全(已知Ksp[Al(OH)3]=2.0×10-33,且溶液中的离子浓度小于1.0×10-5mol·L-1时沉淀完全)。
(3)操作Ⅳ包括________________、________________和干燥。
(4)写出Li2CO3与氢氟酸反应的化学方程式:________________________,该反应不能在玻璃容器中进行的原因是________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石棉是过去常用的保温、绝热、防火材料,但现已确认为致癌物质,并正在开发它的代用品。石棉的组成可用化学式CaMg3(SiO3)4。表示,其中Si的化合价是 ( )
A. +2 B. -2 C. +4 D. -4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知: SOCl2+H2O![]() SO2↑+2HCl↑,下列说法不正确的是
SO2↑+2HCl↑,下列说法不正确的是
A. “酸浸” 时应该用盐酸溶解硅孔雀石粉
B. “氧化”时发生反应的离子方程式为:Cl2+2Fe2+![]() 2Fe3++2Cl-
2Fe3++2Cl-
C. “调pH”时,pH需控制在碱性区域,保证铁元素全部以Fe(OH)3形式除去
D. “加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热条件下,20 mL 18 mol/L的浓H2SO4与过量的碳反应,可得到标况下的CO2
A. 小于4.032L B. 等于4.032L C. 大于4.032L D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com