
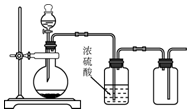
| A. | 用锌和稀硫酸制备H2 | B. | 用铜和稀硝酸制备NO | ||
| C. | 用30%H2O2水溶液和MnO2制备O2 | D. | 用MnO2和浓盐酸制备Cl2 |
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
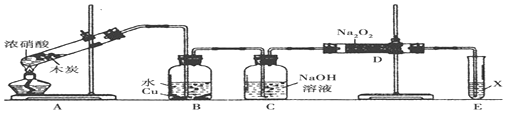
科目:高中化学 来源: 题型:解答题
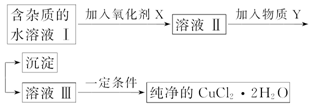
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
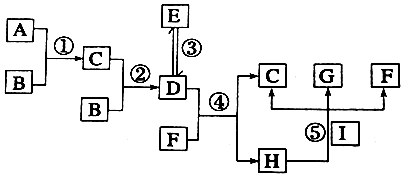
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2.2g | B. | 4.2g | C. | 4.4g | D. | 4.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水分解 | |
| B. | 温度升高,其他溶质的溶解度增大 | |
| C. | 升高温度,降低食盐在水中的溶解度 | |
| D. | 利用阳光、风力蒸发水分使氯化钠成晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
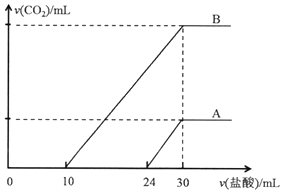 向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.
向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4LCCl4含有的分子数目为NA | |
| C. | 常温常压下,16g甲烷含有共价键数目为4NA | |
| D. | 1L0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com