
| A. | 1 mol羟基与17 g NH3所含电子数都为NA | |
| B. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32 g | |
| C. | 常温常压下,28 g C2H4、C3H6的混合气体中含有碳原子的数目为2NA | |
| D. | 适量铜粉溶解于1 L 0.5 mol•L-1稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4 NA |
分析 A.1个羟基含有9个电子,1个氨气分子含有10个电子;
B.根据阳极Cu-2e═Cu2+,电解精炼铜时阳极为粗铜来分析;
C.C2H4、C3H6的最简式均为CH2;
D.根据3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O及气体是否在标准状况下来分析.
解答 解:A.1 mol羟基含有9mol电子,17 g NH3物质的量为1mol,含电子数都为10NA,故A错误;
B.由Cu-2e═Cu2+,每转移NA个电子时,阳极溶解铜的质量为0.5mol×64g/mol=32g,但阳极材料为粗铜,则阳极溶解铜的质量小于32g,故B错误;
C.C2H4、C3H6的最简式均为CH2,故28g混合物中含有的CH2的物质的量n=$\frac{m}{M}$=$\frac{28g}{14g/mol}$=2mol,即含2mol碳原子,即2NA个,故C正确;
D.若为标准状况,由3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O可计算出溶液中氮原子,但不知是否为标准状况,则无法利用NO的体积来计算其物质的量,故D错误;
故选:C.
点评 本题考查有关物质的量及阿伏伽德罗常数的计算,明确电子数等于质子数、物质的化学键、电解精炼铜原理是解答的关键,并注意气体摩尔体积使用条件和对象,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
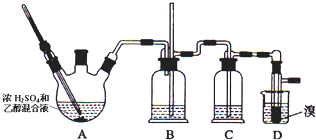
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
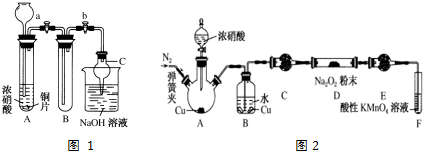
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
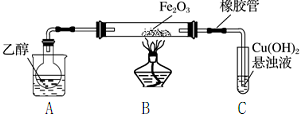
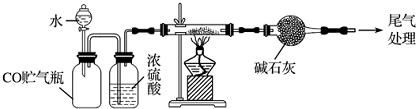
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
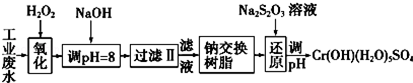
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO、Al2O3的熔点很高,可制作耐高温材料 | |
| B. | 新制氯水久置后变为无色 | |
| C. | 单质硅是光导纤维的主要成分 | |
| D. | 普通玻璃导管口点燃纯净氢气时,火焰呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
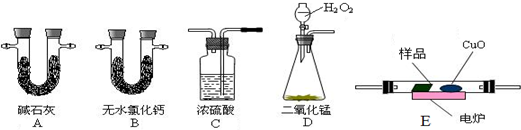
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
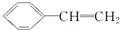 )有下列叙述:
)有下列叙述:| A. | ①②③④⑤ | B. | ①②⑤⑥ | C. | ①②④⑤⑥ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com