
| A. | NaHSO4?Na++H++SO42- | B. | HCO3-+H2O═H3O++CO32- | ||
| C. | HClO═H++ClO- | D. | H2S?H++HS- |
分析 用化学式和离子符号表示电离过程的式子,称为电离方程式.方程式左边写化学式,右边写离子,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开,强电解质用=连接,弱电解质用?连接.
A.NaHSO4是强酸强碱酸式盐,完全电离出Na+、H+、SO42-离子;
B.HCO3-是H2CO3的酸式盐的酸根部分,部分电离;
C.次氯酸酸为弱酸,部分电离;
D.氢硫酸为二元弱酸,分步电离.
解答 解:A.NaHSO4是强酸强碱酸式盐,属强电解质,完全电离用“═”,电离出Na+、H+、SO42-离子,其电离方程式为:NaHSO4=Na++H++SO42-,故A正确;
B.HCO3-是H2CO3的酸式盐的酸根部分,部分电离,其电离方程式为:HCO3-+H2O?H3O++CO32-,故B错误;
C.次氯酸酸为弱酸,部分电离,其电离方程式为:HClO?H++ClO-,故C错误;
D.氢硫酸为二元弱酸,H2S的水溶液中存在平衡:H2S?HS-+H+ 和HS-?S2-+H+,故D错误;
故选A.
点评 本题考查电离方程式的书写,书写电离方程式时注意离子的正确书写、电荷守恒、离子团不能拆开,题目难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
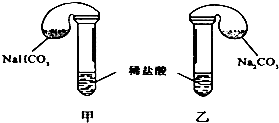 某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:
某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:| | 试剂用量 | 实验现象 (气球体积变化)) | 分析原因 |
| 第 ① 组 | 42 g NaHCO3 53 g Na2CO3 300mL4 mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42 g NaHCO3 53 g Na2CO3 300mL3 mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下11.2L的水中含有0.5 NA个水分子 | |
| B. | 22.4LN2所含的电子数是14NA个 | |
| C. | 常温常压下,1 mol N2和NO的混合气体中含2NA个原子 | |
| D. | 含107g Fe(OH)3的胶体中胶粒总数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2与SO2完全反应时转移电子数为NA | |
| B. | 18g重水(D2O)所含的电子数为10NA | |
| C. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5 NA | |
| D. | 常温常压下,3gHCHO和CH3COOH的混合物中含有0.4NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
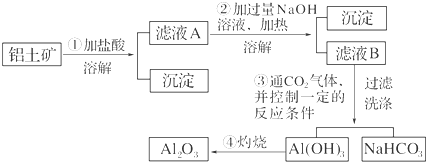
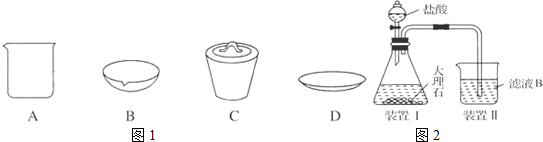
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe 和Zn | B. | Al和Cu | C. | Na和Mg | D. | Mg和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③④⑤ | C. | ①③⑤⑥ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
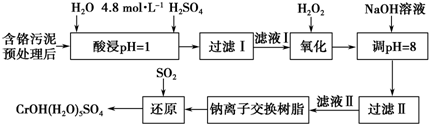
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com