
![]() 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3+ + Cu ==2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- ==Cu2+,还原反应式:2Fe3+ + 2e- == 2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3+ + Cu ==2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- ==Cu2+,还原反应式:2Fe3+ + 2e- == 2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
(1)将反应Zn + 2H+ == Zn2+ + H2↑拆写为两个“半反应式”:其中,氧化反应式为: 。
(2)由题(1)反应,设计成原电池如图所示:
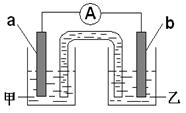
若电极a为Zn ,电极b可选择材料: (只填一种);
电解质溶液甲是 ;电极b处的电极反应式: 。
(3)由反应2H2 + O2 ![]() 2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:
2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:
负极 ,正极 。
(4)以惰性材料为电极,电解100mL PH=6的硫酸铜溶液,当电解池内溶液的PH为1时,电极上析出的铜的质量为 (忽略电解前后溶液体积的变化)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知硝酸与金属反应时,在不同条件下,硝酸有不同的还原产物,甚至在同一反应中可同时得到多种还原产物。现有HNO3、NH4NO3、N2O、H2O、Zn、Zn(NO3)2六种物质,可以利用其中五种物质组成一个完整的化学反应,也可以用六种物质组成一个完整的化学反应。
(1)假设硝酸的还原产物只有一种,利用其中五种物质组成一个完整的化学反应,请写出该化学方程式,并标明电子转移的方向与数目:
__________________________________________________________________________;
(2)上述所写的反应中,被还原的元素是______________,氧化产物是_________________。
(3)如果用六种物质组成一个完整的化学反应,则该反应中还原产物必有__________种,若假定该反应中NH4NO3与N2O的物质的量之比为1∶1,那么该反应中还原剂与氧化剂的物质的量之比为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com