
【题目】下列各组离子中,能在溶液中大量共存的一组是( )
A.K+、NO3-、HCO3-B.Na+、Ba2+、SO42-
C.Fe2+、Cl-、OH-D.K+、NH4+、OH-
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】“关爱生命,注意安全”。惨痛的天津爆炸触目惊心,火灾之后依然火势绵延不绝的原因之一是易燃物中含有电石。工业上常用电石(主要成分为CaC2,杂质为CaS 等)与水反应生产乙炔气。
(1)工业上合成CaC2主要采用氧热法。
已知:CaO(s)+3C(s)=CaC2(s)+CO(g) △H=+464.1kJ·mol-1
C(s)+l/2 O2(g)=CO(g) △H=-110.5kJ.mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO,为维持热平衡,每生产l molCaC2,转移电子的物质的量为_______。
(2)已知2000℃时,合成碳化钙的过程中还可能涉及到如下反应
CaO(s)+C(s)=Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+2C(s)=CaC2(s) K2 △H2=b KJ·mol-1
2CaO(s)+CaC2(s)=3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
则K1=_______ (用含K2、K3的代数式表示);c=_____(用含a、b的代数式表示)。
(3)利用电石产生乙炔气的过程中产生的H2S气体制取H2,既廉价又环保。
利用硫化氢的热不稳定性制取氢气。在体积为2L的恒容密闭容器中,H2S起始物质的量为2mol,达到平衡后H2S的转化率![]() 随温度和压强变化如图所示。据图计算T1℃时平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是 ______。
随温度和压强变化如图所示。据图计算T1℃时平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是 ______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能成功的是
A. 利用酒精萃取溴水中的溴单质
B. 苯和浓溴水反应制取溴苯
C. 加入氢氧化钠溶液以除去乙酸乙酯中的乙酸
D. 用灼烧的方法鉴别棉花和羊毛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【山东省日照市2017届高三下学期第二次模拟考试理科综合化学试题】
以含铅废料(主要含Pb、PbO、PbO2、PbSO4)和稀H2SO4为原料制备高纯Pb、PbO等,实现铅的再生利用。其主要流程如下:

(1)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4,生成1mol PbSO4,转移电子的物质的量是________mol。Fe2+催化过程可表示为:
①2Fe2++PbO2+4H++SO42-=2Fe3++PbSO4+2H2O
②______________________。(用离子方程式表示反应②)
(2)写出脱硫过程发生主要反应的化学方程式:_______________________________。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)==NaHPbO2(aq),其溶解度曲线如右图所示。
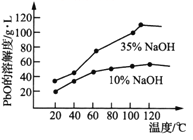
②粗品PbO中所含杂质不溶于NaOH溶液。结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量______(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HC1和NaC1的混合溶液中,得到含Na2PbC14的电解液,电解Na2PbC14溶液,生成Pb,如右图所示。
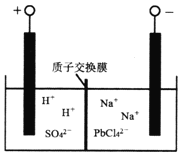
①阴极的电极反应式是__________________________。
②电解一段时间后,Na2PbC14浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应原理和实验装置如下: ![]()
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合液,将混合酸小心加入B中,把17.73mL(15.6g)苯加入A中.向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束.
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤.分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2 , 进行蒸馏纯化,收集205~210℃馏分,得到纯硝酸基苯18.45g.回答下列问题:
(1)装置B的名称是 , 装置C的作用是;
(2)配制混合液时,(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由:;
(3)为了使反应在50~60℃下进行,常用的方法是;
(4)在洗涤操作中,第二次水洗的作用是;
(5)本实验所得到的硝基苯产率是(保留两位有效数字).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com