
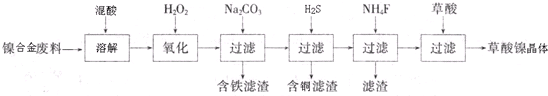
分析 镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4•2H2O),再高温煅烧草酸镍制取三氧化二镍:镍废料加入酸溶解后过滤得到滤液中含有Fe2+、Ca2+、Mg2+、Ni2+,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的PH,使铁离子全部沉淀,过滤后的滤液在加入通入H2S气体沉淀铜离子,过滤后在滤液中加入NH4F沉淀钙离子和镁离子,过滤得到溶液含有Ni2+的溶液,在溶液中加入草酸生成草酸镍,蒸发浓缩结晶析出晶体为目标产物NiC2O4•2H2O,
(1)过氧化氢氧化亚铁离子为铁离子,依据电荷守恒和原子守恒,加入Na2CO3溶液调pH至4.0〜4.5,促进铁离子水解形成氢氧化铁沉淀;
(2)通入H2S气体沉淀铜离子,生成CuS沉淀,加入NH4F沉淀钙离子和镁离子;
(4)次氯酸钠溶液在烧碱溶液中将氯化镍(NiCl2)氧化得到Ni2O3,镍元素化合价升高,则氯元素化合价降低生成氯离子,据此分析;
(5)依据(4)的计算结果和原子守恒分析写出化学式.
解答 解:(1)加双氧水的目的是氧化生成Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,加入碳酸钠溶液的作用是调节pH,促进铁离子水解沉淀完全;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;促进铁离子水解并沉淀完全;
(2)通入H2S气体沉淀铜离子,生成CuS沉淀,离子方程式为:H2S+Cu2+=CuS↓+2H+;加入NH4F沉淀钙离子和镁离子,除去Ca2+、Mg2+离子与镍离子分离;
故答案为:H2S+Cu2+=CuS↓+2H+;除去Ca2+、Mg2+离子;
(4)次氯酸钠溶液在烧碱溶液中将氯化镍(NiCl2)氧化得到Ni2O3,镍元素化合价升高,则氯元素化合价降低生成氯离子,化学方程式为:NaClO+2NiCl2+4NaOH=5NaCl+Ni2O3↓+2H2O;
故答案为:NaClO+2NiCl2+4NaOH=5NaCl+Ni2O3↓+2H2O;
(5)0.2 mol水的质量为3.6g,则m(Ni2O3)=20.2 g-3.6g=16.6g,n(Ni2O3)=0.1mol,即:n(Ni2O3):n(H2O)=0.1mol:0.2 mol=1:2,再利用原子守恒写成结晶水合物的形式,“含2molNi的该物质中含有1mol结晶水”,即:2NiOOH•H2O或 (NiOOH)2•H2O;
故答案为:2NiOOH•H2O或 (NiOOH)2•H2O.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、物质组成的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:填空题
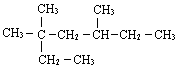 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷 2,3-二甲基1-丁烯
2,3-二甲基1-丁烯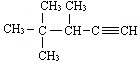 的系统名称为3,4,4-三甲基-1-戊炔
的系统名称为3,4,4-三甲基-1-戊炔 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
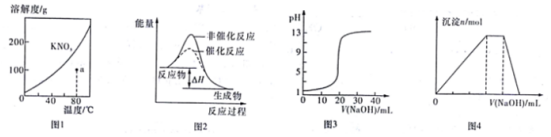
| A. | 图1表示KNO3的溶液曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| B. | 图2表示某放热反应分别有无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示0.1000mol•L-1醋酸溶液得到的滴定曲线 | |
| D. | 图4表示向NH4Al(SO4)2溶液中逐滴滴加NaOH溶液,随着NaOH溶液体积V的变化,沉淀总物质的量n的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
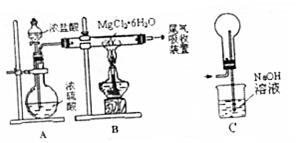
| A. | 装置A制取HCl利用了浓硫酸的吸水性 | |
| B. | 如果直接加热MgCl2•6H2O不能得到MgCl2,将得到Mg(OH)Cl或MgO | |
| C. | 用装置C做为尾气吸收装置,直接与B相连 | |
| D. | 这套装置在设计时未考虑反应结束后滞留在装置中的有害气体的吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氢约含有阿伏伽德罗常数个氢 | |
| B. | 1 molCaCl2 含有1 molCl- | |
| C. | 1 mol电子约含有 6.02×1023个电子 | |
| D. | 1 mol H2O 含有 1 mol H2 和 1 mol O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com