
【题目】下列离子方程式书写正确的是 ( )
A.漂白粉溶液中通入过量的CO2:Ca2+ +2ClO- + CO2 +H2O = CaCO3↓+2HClO
B.实验室用MnO2和浓盐酸制取Cl2:MnO2 + 4HCl(浓)![]() Mn2+ +2Cl- + Cl2↑ + 2H2O
Mn2+ +2Cl- + Cl2↑ + 2H2O
C.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3- + Ba2+ + OH-= BaCO3↓+ H2O
D.钠和冷水反应:Na + 2H2O = Na+ + H2↑+ 2OH-
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,史书记载中也蕴含着丰富的化学知识。下列说法不正确的是 ![]()
![]()
A.《本草经集注》中写到“如握雪不冰。以火烧之,紫青烟起,仍成灰,乃真硝石也”。“硝石”指的是KNO3
B.我国清代《本草纲目拾遗》中记载药物“鼻冲水”,写道:“贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅.虚弱者忌之。宜外用,勿服。”这里的“鼻冲水”是指氨水
C.《神农本草经》说:“水银,镕化(加热)还复为丹。”![]() 黄帝九鼎神丹经
黄帝九鼎神丹经![]() 中的“柔丹”“伏丹”都是在土釜中加热Hg制得的。这里的“丹”是指汞的硫化物
中的“柔丹”“伏丹”都是在土釜中加热Hg制得的。这里的“丹”是指汞的硫化物
D.《后汉书![]() 郡国志》中记载:“石出泉水……其水有肥,燃之极明,不可食,县人谓之石漆。”《酉阳杂俎》一书:“高奴县石脂水,水腻,浮上如漆,采以膏车及燃灯极明。”这里的“石漆”、“石脂水”是指石油
郡国志》中记载:“石出泉水……其水有肥,燃之极明,不可食,县人谓之石漆。”《酉阳杂俎》一书:“高奴县石脂水,水腻,浮上如漆,采以膏车及燃灯极明。”这里的“石漆”、“石脂水”是指石油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的( )

A.△H2+△H3+△H4+△H5+△H6+△H7=△H1
B.△H4的值数值上和Cl-Cl共价键的键能相等
C.△H5<0,在相同条件下,2Br(g)的△H5′<△H5
D.△H7<0,且该过程形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A、B、C、D、E、F等几种常见有机物之间的转化关系图,其中A是面粉的主要成分;C和E反应能生成F,F具有香味。
![]()
在有机物中,凡是具有—CHO结构的物质,具有如下性质:
(1)与新制氢氧化铜悬浊液反应,产生砖红色沉淀;
(2)在催化剂作用下, —CHO被氧气氧化为—COOH,即![]() 。
。
根据以上信息及各物质的转化关系完成下列各题。
(1)B的化学式为_________,C的结构简式为__________。
(2)其中能与新制氢氧化铜悬浊液反应产生砖红色沉淀的物质有_________(填名称)。
(3)C→D的化学方程式为______________。
(4)C + E→ F的化学方程式为 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2![]() 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定稳定下,在容积不变的密闭容器中,进行如下可逆反应:![]() ,下列能表明该反应已达到平衡状态的是
,下列能表明该反应已达到平衡状态的是
①![]()
②![]()
③![]()
④混合气的密度保持不变
⑤混合气体的平均摩尔质量不变
A.仅④B.仅④⑤
C.仅①④D.仅③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为了探究CH3COOH的电离情况,进行了如下实验。
(实验一)测定醋酸溶液中CH3COOH的物质的量浓度。
用 0.2000mol/L 的 NaOH 溶液滴定 20.00mL 醋酸溶液,3 次滴定所消耗NaOH溶液的体积如下:
实验次数 | 1 | 2 | 3 |
消耗NaOH 溶液的体积/mL | 20.05 | 20.00 | 19.95 |
(1)量取 20.00 mL 醋酸溶液所用的仪器是_____(填字母)
|
|
|
|
a | b | c | d |
(2)以上醋酸溶液中CH3COOH的物质的量浓度为_____
(实验二)探究浓度对CH3COOH电离程度的影响。
用 pH 计测定 25℃时不同浓度的醋酸的 pH,结果如下:
浓度/(mol·L-1) | 0.2000 | 0.1000 | 0.0100 |
pH | 2.83 | 2.88 | 3.38 |
(3)根据表中数据可知CH3COOH是_____电解质(填“强”或“弱”) 得出此结论的依据是_____
(4)写出CH3COOH的电离方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答或解释下列问题:
(1)已知:P4(白磷,s) =4P(红磷,s) ΔH=-a kJ·mol-1(a>0),则稳定性:白磷_______红磷(填“大于”或“小于”)。
(2)在常温常压下,1 g 氢气在足量氯气中完全燃烧生成氯化氢气体,放出91.5 kJ 的热量。写出相应的热化学方程式为____________;
(3)将浓氨水滴入到固体氢氧化钠中,可以快速制备氨气,用平衡移动原理解释原因:____________;
(4)常温下,用0.1mol·L-1 NaOH溶液分别滴定20.00 mL 0.1mol/L HCl溶液和20.00 mL0.1 mol/L CH3COOH溶液,得到2条滴定曲线如图所示:

①由A、C点判断,滴定HCl溶液的曲线是__________(填“图1”或“图2”)。
②a=________ mL。
③D点对应离子浓度由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
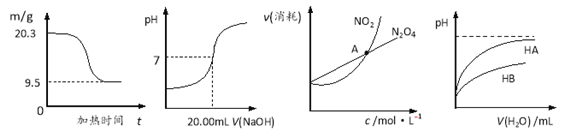
图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com