
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是
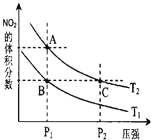
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. A、C两点气体的平均相对分子质量:A>C
【答案】C
【解析】试题分析:A、由图像可知,a、c两点都在等温线上,c的压强大,则a、c两点的反应速率:a<c,A错误;B、由图像可知,a、c两点都在等温线上,c的压强大,与a相比c点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低NO2浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时NO2浓度比a的浓度高,NO2为红棕色气体,则a、c两点气体的颜色:a浅,c深,B错误;C、升高温度,化学平衡正向移动,NO2的体积分数增大,由图像可知,a点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,C正确;D、由图像可知,a、c两点都在等温线上,c的压强大,增大压强,化学平衡逆向移动,c点时气体的物质的量小,混合气体的总质量不变,则平均相对分子质量大,即平均相对分子质量:a<c,D错误,答案选C。


科目:高中化学 来源: 题型:
【题目】二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图
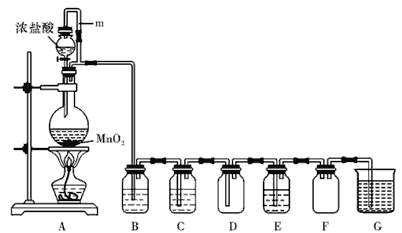
(1)圆底烧瓶中发生反应的化学方程为
(2)若要得到干燥纯净的气体,则B中应盛放的试剂是 C中应盛放的试剂是
(3)E中若装有淀粉碘化钾溶液,能观察到的实验现象是
(4)G中发生反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A.纯银器的表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某条件下,在2 L密闭容器中发生如下反应:2NO2 (g)![]() 2NO (g)+O2 (g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度 (mol·L-1)随时间 (min)的变化如图所示。请回答下列问题:
2NO (g)+O2 (g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度 (mol·L-1)随时间 (min)的变化如图所示。请回答下列问题:
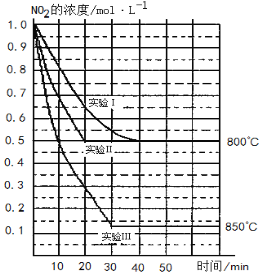
(1)实验Ⅱ隐含的反应条件是 。
(2)实验II中,从反应开始至达到平衡时NO2浓度减少了0.5mol/L,则根据方程式可知生成氧气是0.25mol/L,因此用氧气浓度变化表示的化学反应速率为0.25mol/L÷20min= 。
(3)800℃时,该反应的平衡常数K= 。该反应是 (填“吸” 或“ 放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体 (保持温度不变),此时平衡将向 移动 (填“正反应方向”或“逆反应方向”),你判断的依据是 。
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2![]() 7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】想一想:Ba(OH)2(固态)、CuSO4(固态)、CH3COOH(液态)这些物质为什么归为一类,下列哪个物质还可以和它们归为一类
A. 75%的酒精溶液 B. 硝酸钠(固态) C. Fe(OH)3胶体 D. 豆浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯碱工业叙述正确的是
A. 在阳极区发生还原反应
B. 阴极区流入稀氢氧化钠溶液,流出浓氢氧化钠溶液
C. 常使用阴离子交换膜将电解池的阳极区与阴极区隔开
D. 电解过程中氯离子从阴极区向阳极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质。请回答下列问题:

(1)试管乙中发生的现象是 ,该现象能说明产生的气体具有 性。
(2)写出试管甲中所发生反应的化学方程式,并标明电子转移方向和数目。
(3)试管乙口部浸有碱液的棉花的作用是 。
(4)SO 2 的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,该同学取某一时段的这种雨水V L,加入0.5 mol/L的Ba(OH) 2 溶液至不再产生沉淀时,恰好消耗20.00 mL Ba(OH) 2 溶液。请计算:
①该雨水中共溶解标准状况下SO 2 的体积多少mL?
②若生成沉淀物的质量为2.25 g,求出沉淀物的组成。(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组,称取了10.8g青铜进行研究,他们将青铜放入过量稀盐酸中,得到SnCl2和PbCl2的混合溶液,收集到的气体在101kPa下,冷却到25℃是272mL,冷却到10℃是267mL。已知该青铜合金中铜的质量分数是84.8%,试求该青铜合金中锡、铅的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com