
| A、该一元酸溶液的pH=1 | ||
| B、该溶液中水的离子积常数为1×10-22 | ||
| C、该溶液中HA的电离度为 0.1% | ||
D、若加水稀释,则
|
| 10-14 |
| 10-11 |
| c(H+) |
| c(HA)(初始) |
| 10-14 |
| 10-11 |
| c(H+) |
| c(HA)(初始) |
| 0.001 |
| 0.1 |
| c(OH-) |
| c(H+) |


科目:高中化学 来源: 题型:
| A、原子是由分子构成的 |
| B、原子中含有质子、中子和核外电子 |
| C、原子若失去核外电子,则会变成阴离子 |
| D、原子若得到核外电子,则会变成阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12和6 | B、14和7 |
| C、16和8 | D、18和9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水中提取镁单质的过程仅涉及氧化还原反应 |
| B、往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 |
| C、赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的 |
| D、通过蒸馏法、电渗析法、冷冻法等进行海水淡化的同时,还可得到大量无机盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成原电池的正极和负极必须是两种不同金属 |
| B、在理论上可将该反应:CH4(g)+2O2(g)→CO2(g)+H2O(l)△H<0,设计成原电池 |
| C、在铅、银和盐酸构成的原电池工作时,铅板上有5.175 g铅溶解,正极上就有1 120 mL(标准状况)气体析出 |
| D、原电池工作时,正极和负极上发生的都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、按照系统命名法,化合物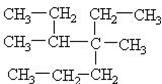 可命名为:4,5-二甲基-4-乙基庚烷 可命名为:4,5-二甲基-4-乙基庚烷 |
B、植物生长平衡因子“S-诱抗素”: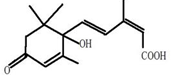 可以发生氧化、取代、酯化、加聚、缩聚反应,与盐酸反应还能生成盐 可以发生氧化、取代、酯化、加聚、缩聚反应,与盐酸反应还能生成盐 |
| C、甲苯的一氯代物和二氯代物的同分异构体总数共有14种 |
| D、分子式为C8H6O2的芳香族化合物中可能含有2个羟基,也可能含有一个羧基,但不可能含有两个醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
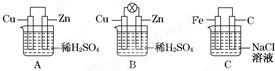 观察图A、B、C,回答下列问题:
观察图A、B、C,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com