D
分析:A、依据气体摩尔体积换算物质的量,结合一氧化氮和氧气反应生成的二氧化氮存在化学平衡分析判断;
B、依据烷烃的分子结构特征分析计算;
C、依据取代基的结构计算电子数;
D、乙烯和环丙烷最简式相同,计算28gCH
2中含有的氢原子数;
解答:A、标准状况下,11.2LNO物质的量为0.5mol,5.6LO
2物质的量为0.25mol,混合后发生反应2NO+O
2=2NO
2;依据反应的定量关系一氧化氮和氧气恰好反应生成二氧化氮气体物质的量为0.5mol,但二氧化氮和四氧化二氮气体存在化学平衡2NO
2?N
2O
4;所以分子数小于0.5mol,故A错误;
B、1mol癸烷C
10H
22所含共价键数=1mol×(22+10-1)=31mol,故B错误;
C、1mol乙烯基CH
2=CH-所含电子数=1mol×(6×2+1×3)=15N
A,故C错误;
D、乙烯和环丙烷最简式相同,所以28g混合气体中含有的氢原子数只要计算28gCH
2中氢原子数即可,28gCH
2中氢原子数=
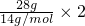
=4mol,即混合气体中含有4N
A个氢原子,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,依据物质的量计算微粒数的方法,关键是一氧化氮和氧气反应生成的二氧化氮存在化学平衡.

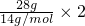 =4mol,即混合气体中含有4NA个氢原子,故D正确;
=4mol,即混合气体中含有4NA个氢原子,故D正确;

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案