
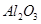 ,含
,含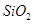 、
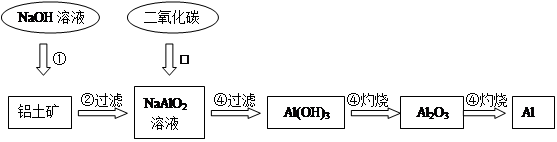
、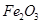 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下: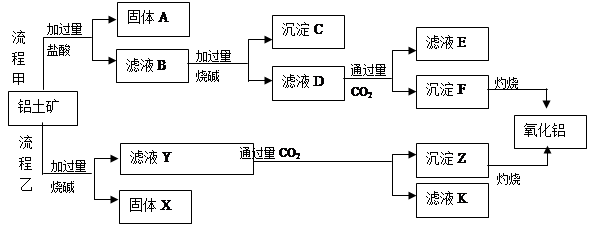
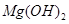 的溶度积常数
的溶度积常数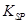 =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.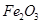 、MgO,滤液通入过量的二氧化碳后,生成了氢氧化铝沉淀,
、MgO,滤液通入过量的二氧化碳后,生成了氢氧化铝沉淀, 的过程中可能会混有二氧化硅杂质。
的过程中可能会混有二氧化硅杂质。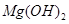 的溶度积常数
的溶度积常数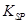 =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,根据溶度积的计算可知溶液的PH最小为11。
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,根据溶度积的计算可知溶液的PH最小为11。

科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁与热水不反应,但是可与水蒸气发生置换反应 |
| B.铝箔在空气中受热可以熔化,剧烈燃烧,产生大量的热 |
| C.常温下,可以用铝或铁制容器来盛装冷的浓硫酸或冷的浓硝酸 |
| D.铝元素是地壳中含量最多的金属元素,而铁是用途最广的金属 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
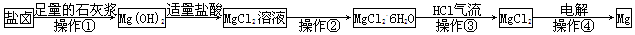
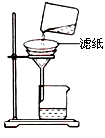
| A.操作①发生的反应为非氧化还原反应 |
| B.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器 |
| C.操作②是蒸发浓缩结晶 |
| D.在整个制备过程中,未发生置换反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 4AlCl3+3O2
4AlCl3+3O2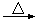 AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。
AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com