
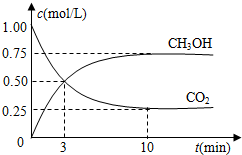
分析 (1)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式可知氢气的浓度变化等于甲醇的浓度变化量3倍为2.25mol/L,根据v=$\frac{△c}{△t}$计算v(H2);
②化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
③能使$\frac{n(C{H}_{3}OH)}{c(C{O}_{2})}$增大,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量;
(2)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式;根据△H-T△H<0来判断反应的自发性.
解答 解:(1)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L•min),故答案为:0.225mol/(L•min);
②反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$,故答案为:K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
③能使$\frac{n(C{H}_{3}OH)}{c(C{O}_{2})}$增大,使平衡向正反应移动,则
A.该反应正反应是放热反应,升高温度平衡向逆反应移动,比值减小,故A错误;
B.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,比值不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应移动,比值增大,故C正确;
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,比值增大,故D正确;
故答案为:CD.
(2)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,2CO=2C+O2(△H>0、△S<0)是一个焓增、熵减的反应,任何情况下不能自发进行,所以无法消除CO的污染,故答案为:2CO2+4e-+2H2O=2CO+4OH-;不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行.
点评 本题考查反应速率计算、化学平衡的影响因素、平衡常数等,题目难度中等,注意基础知识的掌握,把握图象的分析是解答的关键.


科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | NO2 | C. | NO | D. | N2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解过程中,a 电极表面先有红色物质析出,后有气泡产生 | |
| B. | b 电极上发生反应的方程式为:4OH--4e-=2H2O+O2↑ | |
| C. | 曲线 O~P 段表示 O2 的体积变化 | |
| D. | 从开始到 Q 点时收集到的混合气体的平均摩尔质量为 12 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生加成、取代、氧化反应 | |
| B. | 该物质遇FeC13溶液显色,lmol该物质遇浓溴水时最多与1mo1Br2发生取代反应 | |
| C. | 该物质的分子式为C11H14O3 | |
| D. | 1mol该物质最多消耗Na,NaOH,NaHC03的物质的量之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | HA物质的量 浓度(mol/L) | NaOH物质的 量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
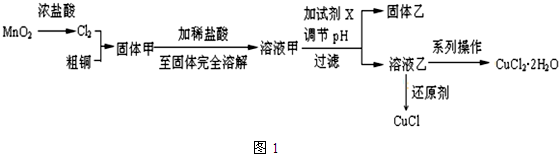
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
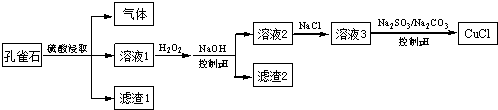
| A. | H2O2将溶液1中Fe2+氧化为Fe3+,再通过控制pH转化为Fe(OH)3除去 | |
| B. | SO32-将溶液3中的Cu2+还原,反应得到CuCl | |
| C. | CO32-作用是控制溶液pH,促使CuCl沉淀的生成 | |
| D. | 若改变试剂加入顺序,将溶液3缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com