
分析 n(NH3)=$\frac{3.4g}{17g/mol}$=0.2mol,则△c(NH3)=$\frac{0.2mol}{2L}$=0.1mol/L,根据v=$\frac{△c}{△t}$计算速率,结合速率之比等于化学计量数之比计算其它物质的反应速率,以此解答该题.
解答 解:n(NH3)=$\frac{3.4g}{17g/mol}$=0.2mol,则△c(NH3)=$\frac{0.2mol}{2L}$=0.1mol/L,
v(NH3)=$\frac{△c}{△t}$=$\frac{0.1mol/L}{5min}$=0.02mol/(L•min),
由υ(NH3):υ(H2):υ(N2)=2:3:1可知υ(H2)=0.03mol/(L•min),υ(N2)=0.01mol/(L•min),
答:υ(NH3)=0.02mol/(L•min),υ(H2)=0.03mol/(L•min),υ(N2)=0.01mol/(L•min).
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析、计算能力,涉及考查化学反应速率,题目难度不大,注意把握反应速率与化学计量数之间的关系.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
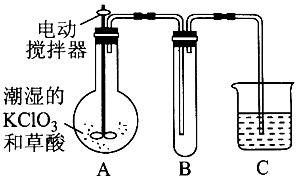
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 | |
| B. | 已知时25℃时Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 | |
| C. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) | |
| D. | 已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c (Mg2+)=1.8×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表中实线是元素周期表的部分边界,其中上边界未用实线标出.
表中实线是元素周期表的部分边界,其中上边界未用实线标出.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mg2+ | 8.1 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常量组分分析 | B. | 微量组分分析 | C. | 痕量组分分析 | D. | 超痕量组分分析 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com