
 酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗盐酸溶液的体积(mL) | 20.05 | 20.00 | 22.10 | 19.95 |
分析 (1)根据称量、溶解、移液、洗涤、定容、摇匀等操作确定实验仪器;
(2)先分析数据的有效性,求出消耗盐酸的平均体积,然后根据关系式NaOH~HCl求出氢氧化钠的物质的量,再计算烧碱样品的纯度;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
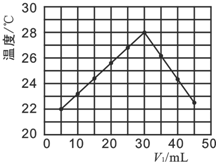
(4)a、从图示观察起始温度即为实验时环境温度;
b、恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL可知,消耗的氢氧化钠溶液的体积为20mL,以此计算NaOH浓度,然后分析溶液中的成分以比较离子浓度;
c、恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL可知,消耗的氢氧化钠溶液的体积为20mL,以此计算NaOH浓度;
d、醋酸电离吸热.
解答 解:(1)配制步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用量筒量取,把浓盐酸倒入烧杯进行溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要玻璃仪器有玻璃棒、烧杯、胶头滴管、250mL容量瓶、量筒,
故答案为:250mL容量瓶;
(2)由于实验3消耗的氢氧化钠的体积与其他差别较大,所以要舍去,V(NaOH)=$\frac{20.05+20.00+19.95}{3}$mL=20.00mL,
NaOH~HCl
1 1
n(NaOH) 0.040mol•L-1×20.00mL
解得:n(NaOH)=0.0008mol,即10.00mL待测溶液含有m(烧碱)=nM=0.0008mol×40g/mol=0.032g,所以250mL待测溶液含有m(烧碱)═0.0800g×$\frac{250}{10}$=0.8g,烧碱的纯度ω(烧碱)=$\frac{0.8g}{1.00g}$×100%=80%;
故答案为:80%;
(3)若操作过程中未用盐酸润洗滴定管,盐酸被稀释,浓度降低,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,
故答案为:偏大;
(4)a、该实验开始时温度是21℃,故a错误;
b、恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL可知,消耗的氢氧化钠溶液的体积为20mL,恰好反应时氢氧化钠溶液中溶质的物质的量是n.
HCl+NaOH=NaCl+H 2O
1 1
1.0mol•L-1×0.03L n
则n=1.0mol•L-1×0.03L=0.03mol,所以浓度为$\frac{0.03mol}{0.02L}$=1.5mol/L,当V1=40时,盐酸的物质的量为0.04mol,NaOH的物质的量为0.015mol,盐酸过量,溶液中c(Na+)<c(Cl-),故b正确;
c.恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL可知,消耗的氢氧化钠溶液的体积为20mL,恰好反应时氢氧化钠溶液中溶质的物质的量是n.
HCl+NaOH=NaCl+H2O
1 1
1.0mol•L-1×0.03L n
则n=1.0mol•L-1×0.03L=0.03mol,所以浓度为$\frac{0.03mol}{0.02L}$=1.5mol/L,故c错误;
d.醋酸电离吸热,放出的热量偏小,不能得到如图的实验结果,故d错误;
故选b.
点评 本题考查了酸碱中和滴定操作、化学计算及误差分析,题目难度中等,注意掌握中和滴定的操作方法、滴定误差的分析方法与技巧,试题有利于培养学生灵活应用所学知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 2n+3-m | B. | a+2-m | C. | n+m+a | D. | a+2n+2-m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
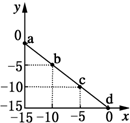 某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )
某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )| A. | 该温度高于25℃ | |
| B. | 图中a点溶液呈碱性 | |
| C. | 该温度下,0.01 mol•L-1的HCl溶液中,由水电离出的H+浓度为10-12 mol•L-1 | |
| D. | 该温度下,等体积浓度均为0.01 mol•L-1的HCl溶液与NaOH溶液恰好完全反应的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合后的溶液 | 加入的酸 | 酸的浓度/(mol•L-1) | 混合后溶液的pH |
| ① | HA | 0.10 | 8.7 |
| ② | HB | 0.12 | 2 |
| A. | HA是强酸,HB是弱酸 | |
| B. | 升高温度,溶液②中$\frac{c({B}^{-})}{c(N{a}^{+})}$增大 | |
| C. | 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | HA物质的量 浓度(mol• L-1) | NaOH物质的 量浓度(mol• L-1) | 混合溶液的 pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| B. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.4NA | |
| C. | 28 g聚乙烯含有的碳原子数为2n NA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$(1×10-8+1×10-10)mol/L | B. | (1×10-8+1×10-10)mol/L | ||
| C. | (1×10-14-5×10-5)mol/L | D. | 2×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化都表现为热量变化 | |
| B. | 需要加热才能发生的反应不一定是吸热反应 | |
| C. | 外界条件与反应是放热还是吸热没有必然联系 | |
| D. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com