

分析 硝酸锶用水溶解,加入重铬酸铵除钡得到BaCr2O7沉淀,过滤分离,滤液中加入硝酸、草酸还原Cr2O72-,再加入氨水中和、沉淀得到Cr(OH)2,可知Cr2O72-被还原为Cr3+,草酸被氧化为二氧化碳,再过滤分离,滤液中加入氨水、醋酸铵、硫化氢,除去Ca2+、Mg2+、重金属,滤液中再加入碳酸氢铵得到碳酸锶,滤液中含有Sr2+,进行循环利用.
(1)步骤①是硝酸锶与重铬酸铵反应得到BaCr2O7沉淀;
(2)步骤②是酸性条件下Cr2O72-被还原为Cr3+,草酸被氧化为二氧化碳;
(3)Cr3+浓度为10-5mol/L沉淀完全,根据Ksp[Cr(OH)3]计算溶液中c(OH-),进而计算控制溶液pH;
(4)加入氨水溶液呈碱性,增大硫离子浓度;
(5)将碳酸氢根离子转化为碳酸根离子;
(6)碳酸锶表面会附着铵盐,加热会分解.
解答 解:硝酸锶用水溶解,加入重铬酸铵除钡得到BaCr2O7沉淀,过滤分离,滤液中加入硝酸、草酸还原Cr2O72-,再加入氨水中和、沉淀得到Cr(OH)2,可知Cr2O72-被还原为Cr3+,草酸被氧化为二氧化碳,再过滤分离,滤液中加入氨水、醋酸铵、硫化氢,除去Ca2+、Mg2+、重金属,滤液中再加入碳酸氢铵得到碳酸锶,滤液中含有Sr2+,进行循环利用.
(1)步骤①是硝酸锶与重铬酸铵反应得到BaCr2O7沉淀,反应离子方程式为:Ba2++Cr2O72-=BaCr2O7↓,
故答案为:Ba2++Cr2O72-=BaCr2O7↓;
(2)步骤②是酸性条件下Cr2O72-被还原为Cr3+,草酸被氧化为二氧化碳,反应离子方程式为:3H2C2O4+8H++Cr2O72-=2Cr3++6CO2↑+7H2O,
故答案为:3H2C2O4+8H++Cr2O72-=2Cr3++6CO2↑+7H2O;
(3)Cr3+浓度为10-5mol/L沉淀完全,Ksp[Cr(OH)3]=6.4×10-31,此时溶液中c(OH-)=$\root{3}{\frac{6.4×1{0}^{-31}}{1{0}^{-5}}}$mol/L=4×10-9mol,溶液pH=-lg$\frac{1{0}^{-14}}{4×1{0}^{-9}}$=5.6,故应控制pH≥5.6,
故答案为:pH≥5.6;
(4)加入氨水溶液呈碱性,增大硫离子浓度,使所有重金属杂质沉淀除去,
故答案为:增大硫离子浓度,使所有重金属杂质沉淀除去;
(5)用氨水控制溶液pH在7~8之间的原因是:将碳酸氢根离子转化为碳酸根离子,确保生成碳酸锶沉淀,
故答案为:将碳酸氢根离子转化为碳酸根离子,确保生成碳酸锶沉淀;
(6)碳酸锶表面会附着铵盐,在200°C烘干使铵盐分解完全,
故答案为:使碳酸锶上吸附的铵盐分解完全.
点评 本题考查物质制备工艺流程,涉及离子方程式书写、对操作与试剂的分析评价、条件控制、物质分离提纯等,关键是对原理的理解.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中X为还原产物 | |
| B. | X能使溴水褪色,说明X具有漂白性 | |
| C. | 该反应中每生成1molFe2O3转移电子数约为6.02×1023 | |
| D. | 该反应生成的气体通入足量Ba(NO3)2溶液中,可得到两种沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:
化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于分离I2与NH4Cl混合物 | |
| B. | 装置②收集并测量Cu与浓硫酸反应产生的气体的体积 | |
| C. | 装置③制取氯气 | |
| D. | 装置④制取无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
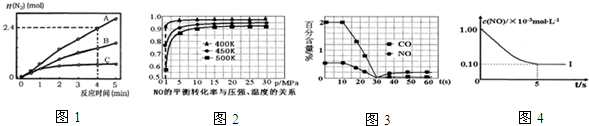
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
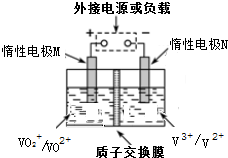 全钒液流储能电池是以溶解于一定浓度硫酸溶液中不同价态钒离子的氧化还原反应来实现化学能和电能相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )
全钒液流储能电池是以溶解于一定浓度硫酸溶液中不同价态钒离子的氧化还原反应来实现化学能和电能相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )| A. | 放电过程中,M电极反应为V02++2H++e一=V02++H20 | |
| B. | 放电过程中,质子通过交换膜从负极区移向正极区 | |
| C. | 充电过程中,N电极上V3+被还原为V2+ | |
| D. | 充电过程中,M电极附近酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH4O | CH2O | CH2O2 | C2H6 | C2H6O | C2H4O | C2H4O2 |
| A. | ①③④ | B. | ②④⑤ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com