
α,β,γ和δ四种生育三烯酚是构成维生素E的主要物质,下列叙述中不正确的是

A.α和δ两种生育三烯酚互为同系物,β和γ两种生育三烯酚互为同分异构体
B.四种生育三烯酚的结构中均不存在手性碳原子
C.四种生育三烯酚均能使三氯化铁溶液显紫色
D.1molα-生育三烯酚与溴的四氯化碳溶液发生反应,理论上最多可消耗3molBr2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
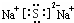
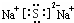
查看答案和解析>>
科目:高中化学 来源: 题型:
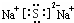
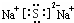
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
| 197b |
| 22.4a |
| 197b |
| 22.4a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com