
如图中每一方格表示有关的一种反应物或生成物.A、C为无色气体.

(1)物质M可以是 或 ,C是 ,F是 .
(2)反应①的化学方程式 .
(3)反应②的离子方程式 .
(4)F→G的化学方程式 .
考点: 无机物的推断.
分析: M既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3,气体A能与淡黄色粉末反应,应是二氧化碳与过氧化钠反应,故A为CO2,则A应为碳酸铵或碳酸氢铵,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3,结合物质的性质进行解答.
解答: 解:M既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3,气体A能与淡黄色粉末反应,应是二氧化碳与过氧化钠反应,故A为CO2,则A应为碳酸铵或碳酸氢铵,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3,
(1)由上述分析可知,M为(NH4)2CO3 或NH4HCO3,C为NH3,F为NO2,
故答案为:(NH4)2CO3 或NH4HCO3;NH3;NO2;
(2)反应①为二氧化碳和过氧化钠的反应,反应方程式为2Na2O2+2CO2═2Na2CO3+O2;
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)反应②是铜和稀硝酸反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8H++2N03﹣=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2N03﹣=3Cu2++2NO↑+4H2O;
(4)二氧化氮和水反应生成硝酸和一氧化氮,化学方程式为:3NO2+H2O=2HNO3+NO↑,
故答案为:3NO2+H2O=2HNO3+NO↑.
点评: 本题考查无机物的推断,M能与酸、碱反应生成气体A、C为解答本题的突破口,然后利用转化关系推出各物质,题目难度中等.


科目:高中化学 来源: 题型:
25℃,水的电离达到平衡:H2O⇌H++OH﹣,下列叙述正确的是( )
|
| A. | 向水中加入稀醋酸,平衡逆向移动,c(H+)降低 |
|
| B. | 向水中加入少量固体碳酸氢钠,c(H+)增大,Kw不变 |
|
| C. | 向水中加入少量固体CH3COONa,平衡正向移动,c(H+)降低 |
|
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)⇌CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
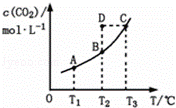
|
| A. | 反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的△H>0 |
|
| B. | 在T2时,若反应处于状态D,则一定有ν正<ν逆 |
|
| C. | 平衡状态A与C相比,平衡状态A的c(CO)小 |
|
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是()
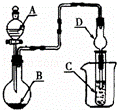
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、CO32﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是()
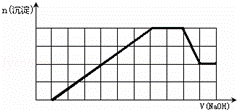
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42﹣和Na+
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D. 反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组混合液:(1)甲酸乙酯和乙酸钠;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液;分离以上各混合液的正确方法依次是( )
|
| A. | 分液、萃取、蒸馏 | B. | 萃取、分液、蒸馏 |
|
| C. | 萃取、蒸馏、分液 | D. | 分液、蒸馏、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②K (Ni(OH)
(Ni(OH) ): 5.0×10-16 , K
): 5.0×10-16 , K (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
|
| A. | H2O的电子式: |
|
| B. | 质量数为14的碳原子: |
|
| C. | CO2的比例模型: |
|
| D. | Cl﹣的结构示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com