
| A. | CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-890kJ | |
| B. | 表示H2S气体燃烧热的热化学方程式为:2H2S(g)+O2(g)═2S(s)+2H2O(l)△H=-136kJ/mol | |
| C. | 2mol H2燃烧得水蒸气放热484 kJ,则:H2O(g)═H2(g)+1/2O2(g)△H=+242 kJ/mol | |
| D. | 2NO+O2=2NO2 △H=+116.2kJ/mol |
分析 A、热化学方程式中焓变单位是mol/L;
B、燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量;
C、热化学方程式改变方向,则反应焓变一定要改变焓变的符号;
D、热化学方程式和物质聚集状态有关,需要标注物质的聚集状态;
解答 解:A、热化学方程式中焓变单位是mol/L,反应的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-890kJ/mol,故A错误;
B、燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,表示H2S气体燃烧热的热化学方程式为:H2S(g)+$\frac{1}{2}$O2(g)═S(s)+H2O(l)△H=-68kJ/mol,故B错误;
C、热化学方程式改变方向,则反应焓变一定要改变焓变的符号,2mol H2燃烧得水蒸气放热484 kJ,2H2(g)+O2(g)=H2O(g)△H=-484 kJ/mol,则:H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ/mol,故C正确;
D、热化学方程式和物质聚集状态有关,需要标注物质的聚集状态,正确的热化学方程式为:2NO(g)+O2(g)=2NO2 (g)△H=+116.2kJ/mol,故D错误;
故选C.
点评 本题考查了热化学方程式书写方法和注意问题,燃烧热概念实质理解应用,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | NaHCO3溶液中加入氢氧化钠溶液:OH-+HCO3-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲表示lmol H2(g)完全燃烧生成水蒸气吸收241.8kJ热量 | |
| B. | 图甲表示2mol H2(g)所具有的能量比2mol H2O(g)所具有的能量多483.6kJ | |
| C. | 图乙表示常温下稀释HA、HB两种酸的图象,得出结论:HA的酸性大于HB的酸性 | |
| D. | 图乙中起始时HA的物质的量浓度大于HB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

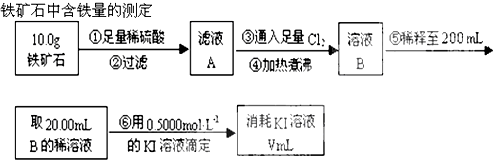
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol稀硫酸与足量NaOH溶液反应 | |
| B. | 稀盐酸与稀Ba(OH)2溶液反应生成1mol水 | |
| C. | 稀盐酸与氨水反应生成1mol水 | |
| D. | 稀NaOH与95%浓硫酸反应生成1mol水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
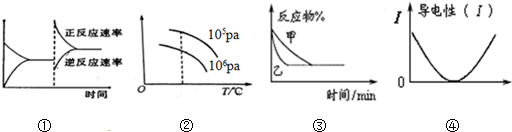
| A. | 图①可表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②可表示对“2SO2(g)+O2(g)?2SO2 (g)△H<0”的平衡体系改变T、P后反应物转化率的变化 | |
| C. | 图③可表示使用催化剂对可逆反应C(s)+H2O(g)?CO(g)+H2(g)的影响 | |
| D. | 图④表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
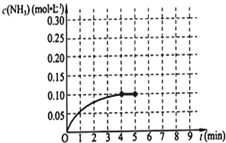 在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
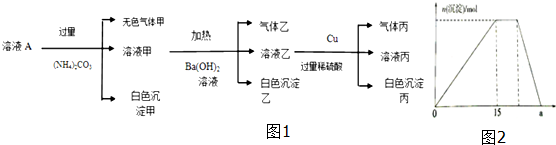
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能的大小:Mg>Al | |
| B. | 锗的第一电离能高于碳而电负性低于碳 | |
| C. | 前四周期的元素,核外电子中未成对的电子个数最多可以达到6个 | |
| D. | F、K、Fe、Ni四种元素中电负性最大的是F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com