
【题目】某温度下,在一个2L的密闭容器中,发生反应3A(g)+2B(g)![]() 4C(s)+2D(g),加入4molA和2molB,2min后达到平衡,测得生成1.6mol C,则下列说法正确的是:
4C(s)+2D(g),加入4molA和2molB,2min后达到平衡,测得生成1.6mol C,则下列说法正确的是:
A.该反应的化学平衡常数表达式是K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.若向平衡体系移走部分D,则此时正反应速率增大
【答案】B
【解析】
A. 依据平衡常数的概念分析列式得到,C为固体不写入平衡常数的表达式,K=![]() ,A项错误;
,A项错误;
B. 依据平衡三段式列式计算;加入4molA和2molB进行反应,反应一段时间后达到平衡,测得生成1.6molC,则
3A(g)+2B(g)![]() 4C(s)+2D(g)
4C(s)+2D(g)
起始量(mol) 4 2 0 0
转化量(mol) 1.2 0.8 1.6 0.8
平衡量(mol) 2.8 1.2 1.6 0.8
则B的转化率![]() ,B项正确;
,B项正确;
C. 反应后气体体积减小,增大压强平衡正向进行,但平衡常数只与温度有关,压强变化平衡常数不变,C项错误;
D. 若向平衡体系移走部分D,则此时正反应的反应物浓度瞬间不变,故正反应速率瞬间并未变化,然后随着反应的进行,正反应速率减慢,D项错误;
答案选B。


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】白磷是一种能自燃的单质,其分子的球棍模型如图所示:![]() ,下列叙述错误的是( )
,下列叙述错误的是( )
A.每个磷原子的价层电子对数为4,磷原子均为sp3杂化
B.每个磷原子形成3个σ键,磷原子为sp2杂化
C.1mol白磷中共含6mol非极性键
D.白磷的分子构型为正四面体形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用.回答下列问题:
(1)![]() 的名称是三硝酸六尿素合铁
的名称是三硝酸六尿素合铁![]() Ⅲ
Ⅲ![]() ,是一种重要的配合物.该化合物中
,是一种重要的配合物.该化合物中![]() 的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___
的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___![]() 碳原子为____杂化,
碳原子为____杂化,![]() 的空间构型为_____.
的空间构型为_____.
(2)尿素分子中![]() 键
键![]() 键的数目之比_____.
键的数目之比_____.
(3)目前发现的铝原子簇![]() 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇![]() 属于____晶体.
属于____晶体.![]() 存在的化学键有_____
存在的化学键有_____![]() 填字母
填字母![]() .
.
A.离子键 ![]() 极性键
极性键 ![]() 非极性键
非极性键 ![]() 配位键
配位键 ![]() 氢键
氢键 ![]() 金属键
金属键
(4)已知: ,反应后,
,反应后,![]() 键_____,
键_____,![]() 键_____
键_____![]() 填“增加”或“减少”
填“增加”或“减少”![]() .
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”,如
键”,如![]() 分子中存在“离域
分子中存在“离域![]() 键”,可表示成
键”,可表示成![]() ,则
,则![]()
![]() 咪唑
咪唑![]() 中的“离域
中的“离域![]() 键”可表示为_________
键”可表示为_________
(6)奥氏体是碳溶解在![]() 中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为
中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为![]() ,则晶胞中最近的两个碳原子之间的距离为______
,则晶胞中最近的两个碳原子之间的距离为______![]() 阿伏加德罗常数的值用
阿伏加德罗常数的值用![]() 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可![]() .
.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是
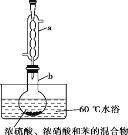
A.水浴加热的优点是使反应物受热均匀、容易控制温度
B.反应完全后,可用仪器a、b蒸馏得到产品
C.实验过程中若发现仪器b中未加入碎瓷片,可冷却后补加
D.将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸, 待冷却至室温后,将所得混合物加入苯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:
数据编号 | 滴入NaOH溶液的体积 | 溶液的pH | |
HX | HZ | ||
1 | 0 | 3 | 1 |
2 |
| a | b |
![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表2,下列判断正确的是
,实验数据如表2,下列判断正确的是![]()
A.通过分析可得表格中![]() ,
,![]()
B.将上述的HZ溶液稀释100倍后pH比HX溶液的pH大
C.由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含锌废渣(主要含Zn以及少量S、Fe、Mn、Cd等)制取氧化锌(ZnO)的工艺流程如图
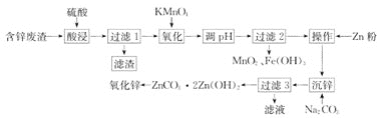
回答下列问题:
(1)“酸浸”时,锌、铁的浸出率如图(a)所示,应控制浸取终点的pH为________。
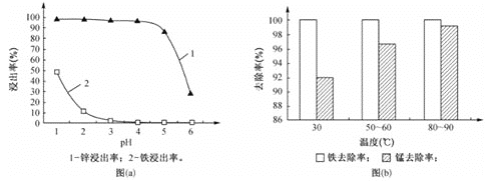
(2)“氧化”时,Fe2+、Mn2+去除率与温度的关系如图(b)所示,相同条件下还原性较强的是________(填“Fe2+”或“Mn2+”),Fe2+被KMnO4氧化生成Fe3+和MnO2的离子方程式为________。
(3)加Zn粉“操作”的目的是________。
(4)“沉锌”的离子方程式为________,由碱式碳酸锌制备轻质氧化锌的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是:
A.pH=7的溶液B.Kw=1.0×10-14的溶液
C.c2(OH-)=KwD.pH=3的酸与pH=11的碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是

A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com