
【题目】氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.0010 mol·L1酸性KMnO4溶液滴定未知浓度的无色NaHSO3溶液,反应的离子方程式为2![]() +5
+5![]() +H+=2Mn2++5
+H+=2Mn2++5![]() +3H2O。请完成下列问题:
+3H2O。请完成下列问题:
(1)该实验除了滴定管(50 mL)、铁架台、滴定管夹、烧杯 、白纸等仪器和用品外,还必须使用的仪器是____________。
(2)实验中用_____(填“酸”或“碱”)式滴定管盛装酸性KMnO4溶液,原因是_______。
(3)本实验_______(填“需要”或“不需要”)使用指示剂,滴定终点的现象是__________。
(4)①滴定前平视液面,刻度为a mL,滴定后俯视刻度为b mL,根据(ba) mL计算得到的待测液浓度比实际浓度_____(填“高”或“低”)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的待测液浓度值会____(填“偏小”“偏大”或“不变”)。
【答案】锥形瓶 酸 酸性KMnO4溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管 不需要 当加入最后1滴KMnO4溶液时,锥形瓶中溶液由无色变为浅红色(或粉红色、红色),且30s不褪色,即达到滴定终点 低 偏大
【解析】
(1)酸性高锰酸钾具有强氧化性,能腐蚀橡胶管,亚硫酸氢钠溶液呈酸性,实验时除用到酸式滴定管(50 mL)、铁架台、滴定管夹、烧杯 、白纸和锥形瓶;
(2)由于KMnO4具有强氧化性,能腐蚀橡胶管,不能用碱式滴定管盛放或取用KMnO4溶液;
(3)滴定时不需要用指示剂,因为MnO4-被还原为Mn2+时紫红色褪去;
(4)①定管的刻度自上而下是逐渐增大的;
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,滴定时,消耗KMnO4溶液体积偏大。
(1)酸性高锰酸钾具有强氧化性,能腐蚀橡胶管,亚硫酸氢钠溶液呈酸性,实验时除用到酸式滴定管(50 mL)、铁架台、滴定管夹、烧杯 、白纸等仪器和用品外,还需要用到锥形瓶,故答案为:锥形瓶;
(2)由于KMnO4具有强氧化性,能腐蚀橡胶管,故不能用碱式滴定管盛放或取用KMnO4溶液,应选择酸式滴定管,故答案为:酸;酸性KMnO4溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管;
(3)滴定时不需要用指示剂,因为MnO4-被还原为Mn2+时紫红色褪去,滴定完成时,NaHSO3溶液没有剩余,溶液会呈高锰酸钾溶液的颜色,且半分钟内颜色不褪去说明NaHSO3溶液已完全被氧化,故答案为:不需要;当加入最后1滴KMnO4溶液时,锥形瓶中溶液由无色变为浅红色(或粉红色、红色),且30s不褪色,即达到滴定终点
(4)①定管的刻度自上而下是逐渐增大的,所以滴定前平视KMnO4液面,刻度为amL,滴定后俯视液面刻度为bmL,则(b-a)mL比实际消耗KMnO4溶液体积偏少,导致测定结果偏低,故答案为:低;
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,滴定时,消耗KMnO4溶液体积偏大,导致测定结果偏高,故答案为:高。


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列表述中一定正确的是![]()
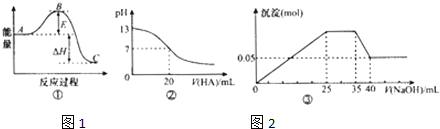
A.若图①中曲线表示![]() ,反应过程的能量变化.则升温或使用催化剂,均会使B点降低,反应速率加快
,反应过程的能量变化.则升温或使用催化剂,均会使B点降低,反应速率加快
B.图②可表示![]() 时,用
时,用![]() 的
的![]() 溶液滴定20mL
溶液滴定20mL![]() NaOH溶液,溶液的pH随加入的酸的体积的变化情况
NaOH溶液,溶液的pH随加入的酸的体积的变化情况
C.若图③表示向含![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则使用的NaOH溶液的浓度为
的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则使用的NaOH溶液的浓度为![]()
D.若图④表示向含![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则
的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则![]() :
:![]()
![]() :
:![]() :3:2
:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、 m、n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是

A.Y、W的最高价氧化物对应的水化物均为强酸
B.Z和Y的简单氢化物的稳定性和沸点高低均为:Z>Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.v的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均釆用虚线表示。
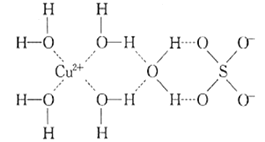
(1)写出与Cu在同一周期且未成对电子数最多的基态原子的电子排布式:______ ,S原子的价层电子排布图______________。
(2)写出胆矾晶体中水合铜离子的结构简式______________(必须将配位键表示出来)。
(3)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式__________。比较NH3和[Cu(NH3)4]2+中H-N-H 中键角的大小:NH3______[Cu(NH3)4]2+(填“>” “<” 或“=”)。
(4)已知H2O2的结构如图:

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因__________________________。
(5)Co3+形成的化合物[Co(NH3)5N3]SO4中Co的配位数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是![]()
![]()

A.用装置①电解氯化铜溶液,则a为阳极,发生氧化反应
B.装置②为原电池,总反应是:![]()
C.图③所示柱形图,纵坐标表示第二周期元素最高正价随原子序数的变化
D.图④所示曲线,表示该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、M、Y、Z是元素周期表前四周期的六种元素,原子序数依次递增。已知:
①Z位于ds区,最外能层没有单电子,其余的均为短周期主族元素;
②Y原子价电子排布为msnmpn(m≠n);
③M的基态原子2p能级有1个单电子;
④Q、X原子p轨道的未成对电子数都是2。
用化学术语回答下列问题:
(1)Z在周期表中的位置______________。
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为__________ (用对应元素的符号填写)。
(3)X、M两元素形成的化合物XM2的VSEPR模型名称为_________,已知XM2分子的极性比水分子的极性弱,其原因是__________________。
(4)分析下表中两种物质的键能数据(单位:kJ/mol)。
A—B | A=B | A≡B | |
QX | 357.7 | 798.9 | 1 071.9 |
R2 | 154.8 | 418.4 | 941.7 |
①结合数据说明QX比R2活泼的原因:________________________。
②QX与R2互为等电子体,QX的结构式为(若有配位键请用→表示)______。Fe易与QX形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,则此配合物化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,![]() ______ 。
______ 。
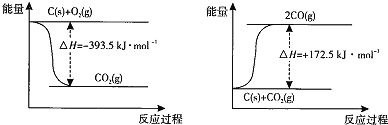
(2)在体积为2L的密闭容器中,充入1mol ![]() 和3mol H,一定条件下发生反应:
和3mol H,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的物质的量随时间变化的曲线如图所示:
的物质的量随时间变化的曲线如图所示:

①从反应开始到平衡,![]() 的平均反应速率
的平均反应速率![]() ______ 。
______ 。
②下列措施中能使化学平衡向正反应方向移动的是 ______ ![]() 填编号
填编号![]() 。
。
A.升高温度
![]() 将
将![]() 及时液化移出
及时液化移出
C.选择高效催化剂
![]() 再充入1mol
再充入1mol ![]() 和4mol
和4mol ![]()
(3)![]() 溶于水生成碳酸。已知下列数据:
溶于水生成碳酸。已知下列数据:
弱电解质 |
|
|
电离平衡常数 |
|
|
现有常温下![]() 的
的![]() 溶液,已知:
溶液,已知:![]() 水解的平衡常数
水解的平衡常数![]() ,
,![]() 第一步水解的平衡常数
第一步水解的平衡常数![]() 。
。
①判断该溶液呈 ______ ![]() 填“酸”、“中”、“碱”
填“酸”、“中”、“碱”![]() 性,写出该溶液中
性,写出该溶液中![]() 发生第一步水解的离子方程式 ______ 。
发生第一步水解的离子方程式 ______ 。
②下列粒子之间的关系式,其中正确的是 ______ 。
A.![]()
B.![]()
C.![]()
D.![]()
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以CO和![]() 为原料做成电池。原理如图所示:
为原料做成电池。原理如图所示:
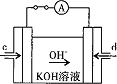
通入CO的管口是 ______ ![]() 填“c”或“d”
填“c”或“d”![]() ,写出该电极的电极反应式: ______ 。
,写出该电极的电极反应式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y原子的最外层电子数是电子层数的2倍,Z是地壳中含量最高的非金属元素,Q元素形成的单质是重要的半导体材料,R元素原子核外的M电子层电子数比L层少2个。请回答下列问题:
(1)画出Z的原子结构示意图__________,其氢化物的电子式__________。
(2)![]() 、Z、Q三种元素的原子半径由大到小的顺序__________
、Z、Q三种元素的原子半径由大到小的顺序__________![]() 用元素符号表示
用元素符号表示![]() 。
。
(3)![]() 元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________
元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________![]() 填字母序号
填字母序号![]() 。
。
![]() 过渡元素区域
过渡元素区域
![]() 金属和非金属元素的分界线附近
金属和非金属元素的分界线附近
![]() 含有氟、氯、硫、磷等元素的区域
含有氟、氯、硫、磷等元素的区域
![]() 下列能说明Y与R元素非金属性相对强弱的是__________。
下列能说明Y与R元素非金属性相对强弱的是__________。
![]() 单质与氢气化合的难易程度
单质与氢气化合的难易程度
![]() 含氧酸的酸性:
含氧酸的酸性:![]()
![]() 与R相互形成的化合物中元素的化合价
与R相互形成的化合物中元素的化合价
Ⅱ![]() 已知:
已知:

合成氨的热化学方程式是___________________________________。
Ⅲ![]() 有人设想以
有人设想以![]() 和
和![]() 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的精细化工产品,被广泛用于制药、染料、农药及日用化工。以下为其中一种合成二甲醚的方法:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
③2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ·mol-1。
(2)某温度下在容积为2L的密闭容器中加入CH3OH(g)发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.4 | 0.2 | 0.02 | 0.02 |
①前2min内,H2O(g)的平均反应速率为________mol·L-1·min-1;此反应在该温度下的平衡常数为________;若再向容器中分别加入CH3OH(g)0.02mol、CH3OCH3(g)1.0mol,此时该反应中υ正________υ逆(填“>”、“<”或“=”)。
②根据文献,甲醇的转化率可以根据冷凝的液相中甲醇与水的百分含量来计算(忽略挥发到气相的甲醇),若以A表示冷凝液中水的质量分数,B表示冷凝液中甲醇的质量分数,则甲醇的转化率α(CH3OH)=________。
(3)一定条件下,发生反应③,原料气中![]() 和温度对CO2转化率影响的实验数据如图所示。
和温度对CO2转化率影响的实验数据如图所示。
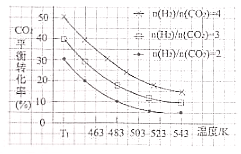
结合图像,可得出CO2平衡转化率受外界条件影响的变化规律为:
a:________;
b:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com