
| A. | CO2+2OH-═CO32-+H2O | B. | Al2O3+2OH-+═2 AlO2-+H2O | ||
| C. | Al3++4OH-═AlO2-+2H2O | D. | 2 Al+2OH-+6H2O═2 AlO2-++3 H2↑ |
分析 加入过量NaOH浓溶液,二氧化碳与NaOH反应生成碳酸钠与水,再过一段时间,罐壁又重新凸起,发生Al与NaOH溶液的反应生成氢气,因铝罐表面有氧化膜Al2O3,则又能够发生反应:Al2O3+2OH-+3H2O→2[Al(OH)4]-以此来解答.
解答 解:向集满CO2的铝罐中加入过量氢氧化钠,首先CO2与氢氧化钠反应,发生反应为:CO2+2OH-→CO32-+H2O,表现为铝罐变瘪;接着过量的氢氧化钠再与铝罐反应生成氢气,发生反应为:2Al+2OH-+6H2O→2[Al(OH)4]-+3H2↑,则罐壁又重新凸起;
因铝罐表面有氧化膜Al2O3,则又能够发生反应:Al2O3+2OH-+3H2O→2[Al(OH)4]-,
根据分析可知,能够发生反应为A、B、D,没有发生的反应为C,
故选:C.
点评 本题考查离子反应的书写,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意结合现象判断发生的反应,注意氧化铝的两性,题目难度不大.


科目:高中化学 来源: 题型:实验题
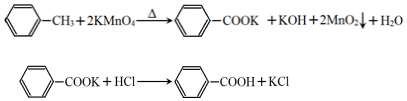
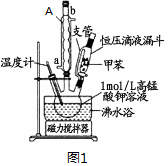
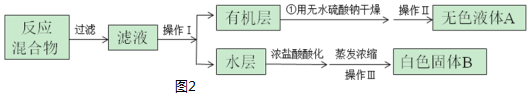
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 | |
| C. | 常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) | |
| D. | 对于反应N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4 L H2含有的原子数是2NA | |
| B. | 标准状况下,NA个水分子的体积是22.4 L | |
| C. | 任何情况下,1 mol CO中都含有NA个分子 | |
| D. | 通常状况下,NA个NH3分子的体积是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下11.2 L乙烯气体含有的分子数为0.5NA | |
| B. | 1 L 1 mol•L-1CH3COONa溶液中含有NA个CH3COO- | |
| C. | 1 mol-OH(羟基)中含有10 NA个电子 | |
| D. | 16gCH3OH分子中含有的共价键数目为2.5NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
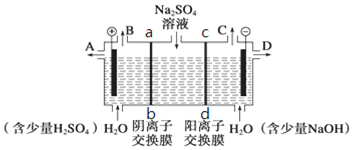
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质(杂质) | 试剂 |
| A | Al2O3(SiO2) | 过量NaOH溶液 |
| B | CO2(HCl) | 饱和Na2CO3溶液 |
| C | Na2O2(Na2O) | O2/加热 |
| D | Al2O3(Fe2O3) | Al粉/加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com