
【题目】合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)△H= - 92.4kJmol-1,在反应过程中,正反应速率的变化如图.下列说法不正确的是( )
2NH3(g)△H= - 92.4kJmol-1,在反应过程中,正反应速率的变化如图.下列说法不正确的是( )
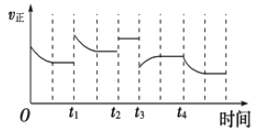
A. t1时增大了压强
B. t2时使用了催化剂
C. t3时降低了温度
D. t4时从体系中分离出部分氨气
科目:高中化学 来源: 题型:
【题目】(1)已知反应 2HI(g)![]() H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
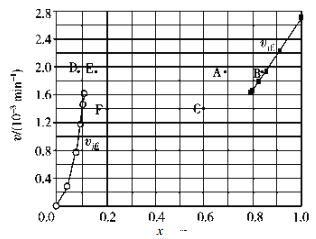
(2)Bodensteins 研究了下列反应:2HI(g) ![]() H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为__________(填字母)和__________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
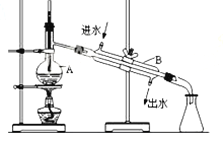
(1)指出图中明显的错误________________;________________;
(2)A仪器的名称是________________;B仪器的名称是________________;
(3)萃取、分液实验中所用主要玻璃仪器的名称是________________,静置后分液的第一步操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是__________(填“增大”“不变”或“减小”,以下相同)。
(2)将容器的体积缩小一半,其正反应速率__________,逆反应速率__________。
(3)保持体积不变,充入N2 使体系压强增大,其正反应速率__________,逆反应速率__________。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率__________,逆反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
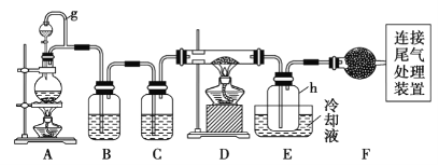
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:______________________________。
(2)装置F的名称是___________________;装置C中的试剂是_____________;装置E中的h瓶需要冷却的理由是_____________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O。
①滴定前是否要滴加指示剂?________(填“是”或“否”)。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请从下列化学方程式中选择正确答案,将其编号填入相应括号内。
a.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
b.2Fe+3Cl2![]() 2FeCl3
2FeCl3
c.NH4HCO3![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
d.CaO+CO2=CaCO3
e.Cl2+H2O=HCl+HClO
(1)既是分解反应又是氧化还原反应的是(_________)
(2)是分解反应但不是氧化还原反应的是(_________)
(3)既是化合反应又是氧化还原反应的是(_________)
(4)是化合反应但不是氧化还原反应的是(_________)
(5)不属于四种基本反应类型的氧化还原反应的是(_________)
查看答案和解析>>
科目:高中化学 来源: 题型:
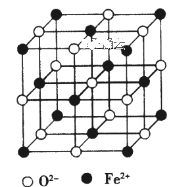
【题目】以铁矿石(Fe2O3)为起始物,经过一系列反应可以得到Fe3[Fe(CN)6]2和Fe(SCN)3,请回答下列问题:
(1)写出Fe的原子结构示意图_____________,O原子核外电子轨道表示式为__________。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为____________。SCN-的空间构型__________________
(3)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为________________,该化学键能够形成的原因是________________________________________________________________。
(4)K3[Fe(CN)5NO]的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是_________________,该配合物中铁原子的配位数是________________。
(5)FeO晶胞结构如图所示,FeO晶体中Fe2+配位数为________________,若该晶胞边长为anm,则该晶体密度为_________g·cm-3(阿伏伽德罗常数的值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com