
| A. | 待测液中加入氯化钡溶液有白色沉淀生成,再加稀盐酸,沉淀不消失,则待测液中一定有硫酸根离子 | |
| B. | 用灼烧的方法可鉴别丝绸与棉布 | |
| C. | 无色溶液中加入Na2CO3溶液产生白色沉淀,则该无色溶液中含有Ca2+ | |
| D. | 待测液中加入AgNO3溶液,有白色沉淀生成,则待测液中含有Cl- |
分析 A.不能排除AgCl的干扰;
B.丝绸主要成分为蛋白质,灼烧有烧焦的羽毛气味;
C.可能生成碳酸钡等沉淀;
D.可能生成碳酸银、硫酸银等沉淀.
解答 解:A.不能排除AgCl的干扰,检验硫酸根离子,应先加入盐酸,如无现象,再加入氯化钡溶液检验,故A错误;
B.丝绸主要成分为蛋白质,灼烧有烧焦的羽毛气味,可用灼烧的方法检验,故B正确;
C.可能生成碳酸钡等沉淀,不一定含有Ca2+,故C错误;
D.可能生成碳酸银、硫酸银等沉淀,应先加入硝酸,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子检验、离子反应等,把握离子检验的方法、试剂及现象为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题
 金属及其化合物在科学研究和工业生产中具有许多用途.回答下列问题:
金属及其化合物在科学研究和工业生产中具有许多用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 不能使酸性KMnO4溶液褪色 | B. | 该有机物中-OH能氧化为-CHO | ||
| C. | 能发生加成、取代、消去反应 | D. | 1mol该物质最多可与1molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44 | B. | 48 | C. | 64 | D. | 71 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
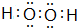 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com