
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:计算题
碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。
其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1) 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为____________。
(2) 碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;
③ 。
(3) 若pH过高,则对产品的影响是 。
(4) 为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下)。在所得溶液中加过量氨水,得到白色沉淀,经过滤、洗涤沉淀、充分灼烧得到1.02g固体。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
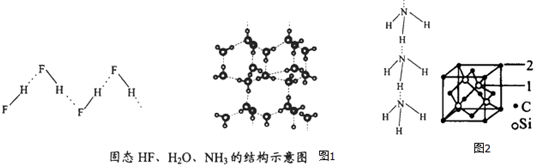
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3+NaOH═NaAlO2+2H2O | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | Na2O+CO2═Na2CO3 | D. | 2NaHCO3═Na2CO3+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | He |
| 2 | B | C | D | |||||
| 3 | E | F | G | H | I | J | K | L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液中加入少量的氨水:Al3++3OH-═Al(OH) 3↓ | |
| B. | 向碳酸钠溶液中加入饱和石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 向氢氧化钠溶液中通入过量的氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 向稀硫酸中加入过量铁粉,先后发生两个反应:2Fe+6H+═2Fe3++3H2↑,Fe+2Fe3+═3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的O2比O3的能量低,由O2变O3为放热反应 | |
| B. | 等质量的O2比O3的能量高,由O2变O3为吸热反应 | |
| C. | O3比O2稳定,由O2变O3为放热反应 | |
| D. | O2比O3稳定,由O2变O3为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com