
| BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 | |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |
| 1 |
| 8 |
| 1 |
| 2 |
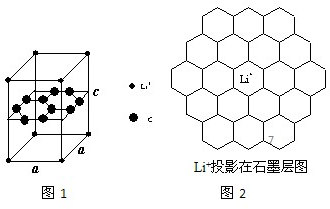
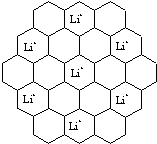 ;根据化学键的成键粒子的特点可知,由于成键的有Li+,由此可判断化学键应为离子键,
;根据化学键的成键粒子的特点可知,由于成键的有Li+,由此可判断化学键应为离子键, ;离子键;
;离子键;

科目:高中化学 来源: 题型:
| A、pH=5的盐酸溶液稀释1000倍 |
| B、pH=9的烧碱溶液稀释1000倍 |
| C、pH=9的氨水稀释1000倍 |
| D、pH=4的盐酸溶液与pH=10的烧碱溶液等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②③④ |
| C、①③⑥ | D、①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 | B、2.0 |
| C、3.0 | D、4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液、胶体和浊液的本质区别在于分散质粒子的直径不同 |
| B、CO2溶于水形成的溶液能导电,所以CO2是电解质 |
| C、溶于水后能电离出氢离子的化合物都是酸 |
| D、氧化还原反应的本质是化合价发生升降 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
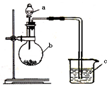 已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强.某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验.根据要求回答问题:
已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强.某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验.根据要求回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com