
| 1000mL |
| 20mL |
| 3.36g |
| 10g |


科目:高中化学 来源: 题型:
| A、[H2S]+[HS-]+[S2-]=0.1 |
| B、[Na+]+[H+]=2[S2-]+[HS-]+[OH-] |
| C、[OH-]=[H+]+[HS-]+2[H2S] |
| D、[Na+]+[H+]=[S2-]+[HS-]+[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:
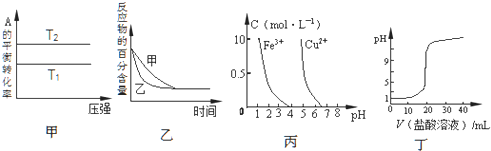
| A、由图甲可以判断:T1>T2,且反应的△H<0 |
| B、图乙表示压强对可逆反应2A(g)+2 B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、根据图丙,若除去CuSO4溶液中的Fe2+,可先向溶液中加入适量双氧水,再调节pH≈4 |
| D、图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
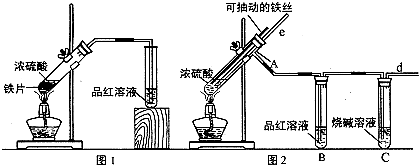
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B单质可能是金属,也可能是非金属 |
| B、B与A形成的化合物一定是离子化合物 |
| C、C单质只有氧化性 |
| D、原子半径:C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答:
短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 甲 池 | H2SO4(aq) | CuCl2(aq) | HCl(aq) | NaOH(aq) |
| 乙 池 | AgNO3(aq) | K2SO4(aq) | NaCl(aq) | CuSO4(aq) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com