
对于常温下pH=3的乙酸溶液,下列说法正确的是双选) )。
A.cH+)=cCH3COO-)+cOH-)
B.加水稀释到原体积的10倍后溶液pH变为4
C.加入少量乙酸钠固体,溶液pH升高
D.与等体积pH为11的NaOH溶液混合后所得溶液中:cNa+)=cCH3COO-)
解析 A项,由醋酸溶液中的电荷守恒可知,正确;B项,醋酸是弱酸,溶液越稀越电离,所以加水稀释10倍时,醋酸电离程度增大,所得溶液cH+)大于原溶液的10倍,故pH<4,错误;C项,加入乙酸钠固体,抑制醋酸电离,cH+)减小,溶液pH升高,正确;D项,pH为11的NaOH溶液中cOH-)与pH=3的乙酸溶液中cH+)相等,但醋酸是弱酸,部分电离,所以醋酸溶液溶质浓度大于NaOH溶液溶质浓度,两者等体积混合时,酸过量,最终溶液呈酸性,cH+)>cOH-)溶液中存在电荷守恒式:cNa+)+cH+)=cCH3COO-)+cOH-),所以cNa+)<cCH3COO-),错误。
答案 AC


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12 mol3·L-3,Ksp[MgF2]=7.42×10-11 mol3·L-3。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的[Mg2+]大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,[Mg2+]增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后, Mg(OH)2不可能转化为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol·L-1的二元酸H2A溶液的pH=4,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有[Na+]+[H+]=[HA-]+[OH-]+2[A2-]
D.在Na2A溶液中一定有[Na+]>[A2-]>[H+]>[OH-]
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3酸性溶液脱除H2S后的溶液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol·L-1的FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是_________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应: _________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol·L-1。
②Ⅳ中检测Cl2的实验方法_________________。
③与Ⅱ对比,得出的结论(写出两点): _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中微粒的物质的量浓度关系正确的是双选) )。
A.在0.1 mol·L-1 NaHCO3溶液中:cNa+)>cHCO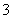 )>cCO
)>cCO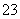 )>cH2CO3)
)>cH2CO3)
B.在0.1 mol·L-1 Na2CO3溶液中:cOH-)-cH+)=cHCO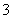 )+2cH2CO3)
)+2cH2CO3)
C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:cCO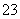 )>cHCO
)>cHCO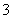 )>cOH-)>cH+)
)>cOH-)>cH+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,cNa+)=0.1mol·L-1]:cNa+)
=cCH3COO-)>cCH3COOH)>cH+)=cOH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 )。
A.34S原子核内的中子数为16
B.1H和2H的化学性质相同
C.H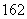 O与H
O与H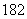 O的化学性质相同
O的化学性质相同
D.Na和Na+的组成元素相同,且性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,体积为2 L的密闭容器中A、B、C三种气体的起始浓度和平衡浓度如下表:
| 物质 | A | B | C |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法中正确的是( )
A.发生的反应可表示为A+B2C
B.反应达到平衡时B的转化率为25%
C.若起始时密闭容器中有0.1 mol A、0.1 mol B、0.2 mol C时,反应达平衡时,c(A)=0.05 mol·L-1
D.改变起始时容器中各气体的物质的量,可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列 化学反应在理论上可以设计成原电池的是___________。
化学反应在理论上可以设计成原电池的是___________。
A.C(s)+H2O(g)====CO(g)+H2(g) ΔH>0
B.NaOH( aq)+HCl(aq)====NaCl(aq)+H2O(l) ΔH<0
aq)+HCl(aq)====NaCl(aq)+H2O(l) ΔH<0
C.2H2(g)+O2(g)====2H2O(l) ΔH<0
(2)以KOH溶液为电解质溶液,依据你所选反应,设计一个原电池,其负极反应为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.天然气和沼气的主要成分是甲烷
B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
C.纤维素乙酸酯、油脂和蛋白质在一定条件下都能水解
D.葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com