
| A. | 1.25g | B. | 1.32g | C. | 1.97g | D. | 2.44g |
分析 CH4燃烧产物为CO、CO2、H2O(g),产物通过浓硫酸时,浓硫酸的作用是吸收水分,浓硫酸增重2.52g为水的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO和CO2的总的物质的量,再根据二者质量可计算CO2的物质的量,进而计算CO2质量.
解答 解:当其产物缓慢经过浓硫酸时,浓硫酸增重2.52g为水的质量,
所以n(H2O)=$\frac{2.52g}{18g/mol}$=0.14mol,
根据H原子守恒,可知:n(CH4)=$\frac{1}{2}$n(H2O)=$\frac{1}{2}$×0.14mol=0.07mol,
根据C原子守恒,则:n(CO)+n(CO2)=0.07mol,
所以m(CO)+m(CO2)=4.96g-2.52g=2.44g,
所以[0.07mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=2.44g,
解之:n(CO2)=0.03mol,
所以生成二氧化碳的质量为0.03mol×44g/mol=1.32g.
故选B.
点评 本题考查混合物的计算,题目难度中等,注意从原子守恒的角度解答,关键根据水的质量判断甲烷的物质的量.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
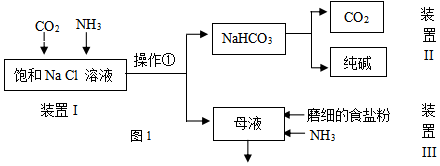
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
| 溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于实验室制取少量 NH3或 O2 | |
| B. | 可用从 a 处加水的方法检验装置②的气密性 | |
| C. | 实验室可用装置③收集 H2、NH3 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中 b 为阳离子交换膜、c 为阴离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.  .
. $→_{K_{2}CO_{3}}^{(CH_{3})_{2}SO_{4}}$
$→_{K_{2}CO_{3}}^{(CH_{3})_{2}SO_{4}}$ (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “可燃冰”是将水变为油的新型燃料 | |
| B. | 氢气是具有热值高、无污染等优点的燃料 | |
| C. | 天然气、海洋能、太阳能、生物质能、风能、氢能 都属于新能源 | |
| D. | 电能是一次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
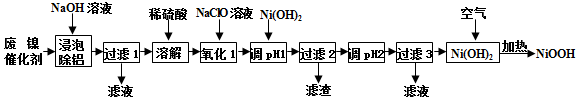
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
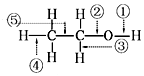
| A. | 当乙醇发生催化氧化时,被破坏的键是②③ | |
| B. | 当乙醇与Na反应时,被破坏的键是① | |
| C. | 当乙醇与乙酸反应时,被破坏的键是② | |
| D. | 当乙醇发生催化氧化时,被破坏的键是①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
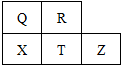 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )| A. | 五种元素中Z的活动性最弱,T 的最高价氧化物对应水化合物酸性最强 | |
| B. | 氢化物的稳定性:R>Q>X;R>T>X | |
| C. | Q单质能从溶液中置换出X单质,R单质能从溶液中置换出Q单质 | |
| D. | X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
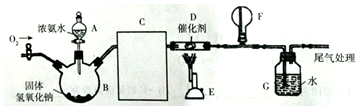
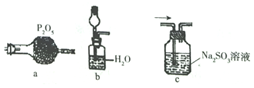
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com