



科目:高中化学 来源: 题型:
| A、112L/h |
| B、224 L/h |
| C、448 L/h |
| D、560L/h |
查看答案和解析>>
科目:高中化学 来源: 题型:
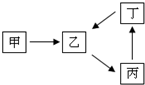 甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.| 温度/℃ | 400 | 450 | 500 | 550 | 600 | 650 |
| 转化率/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
| 3 |
| 4 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入硝酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 向淀粉KI溶液中不断通入C12 | 溶液变蓝后褪色 | C12先表现氧化性后 表现漂白性 |
| C | CO还原Fe2O3得到的黑色固体加入 盐酸溶解后再加入KSCN溶液 |
溶液不显红色 | 该黑色固体是Fe |
| D | 将SO2通入BaCl2溶液中 | 没有白色沉淀生成 | BaSO3可溶于酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
| B、c(Na+)>c(HSO3-)+c(SO32-) |
| C、c(Na+)+c(H+)=2c(SO32-) |
| D、c(Na+)+c(H+)=c(HSO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4L的CO气体和1mol N2所含的电子数相等 |
| B、1L密度为1.84g?cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA |
| C、在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA |
| D、1mol/L FeCl3 溶液中,含有Cl-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L乙醇所含的羟基数为0.5NA |
| B、电解硫酸铜溶液时,阳极每生成标准状况下3.36L气体,电路中转移电子数为0.6NA |
| C、1mol Cu与足量的硫固体反应转移的电子数为2NA |
| D、标准状况下,30g NO和16g O2混合所生成的气体分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com