
| A. | 乙酸丁酯 | B. | 甲酸乙酯 | C. | 乙酸甲酯 | D. | 乙酸乙酯 |
分析 同温同压下,相同质量的Y和Z的蒸气所占体积相同,根据阿伏加德罗定律可得Y和Z的物质的量相等,进一步推得Y和Z的相对分子质量相等,分子中含有n个C原子的饱和一元醇的相对分子质量与分子中含有(n-1)个C原子的饱和一元羧酸的相对分子质量相等,则:Mr(CnH2n+2O)=Mr[C(n-1)H2(n-1)O2]=14n+18.
解答 解:同温同压下,相同质量的Y和Z的蒸气所占体积相同,根据阿伏加德罗定律可得Y和Z的物质的量相等,进一步推得Y和Z的相对分子质量相等,
A.乙酸丁酯水解生成乙酸与丁醇,相对分子质量分别为60和74,故A错误;
B.甲酸乙酯水解生成甲酸和乙醇,相对分子质量都为46,故B正确;
C、乙酸甲酯水解生成乙酸和甲醇,相对分子质量分别为60和32,故C错误;
D、乙酸乙酯水解生成乙酸和乙醇,相对分子质量分别为60和46,故D错误;
故选B.
点评 本题难度不大,考查酯的水解,掌握酯的水解的性质,判断产物关系是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O的质量为18 g/mol | |
| B. | CH4的摩尔质量为16 g | |
| C. | 3.01×1023个SO2分子的质量为32 g | |
| D. | 标准状况下,1mol任何物质体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
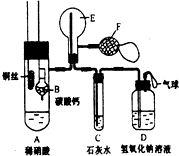 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球. 查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方法 | 实验现象 | 结 论 |
| 在溶液中加KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=c |
| A. | 甲中:若a=7,则HA是强酸 | |
| B. | 乙中:若b≠0.2,则c(A-)≠c(Na+) | |
| C. | 丙中:若HA是弱酸,则c(A-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 丁中:若c=9,则c(OH-)-c(HA)=10-9mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com